
【题目】下列说法正确的是
A. 强酸跟强碱的反应热一定是中和热
B. 1molC完全燃烧放热383.3kJ,其热化学方程为:C+O2=CO2ΔH=-383.3kJ·mol-1
C. 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D. 表示中和热的离子方程式为:H+(aq)+OH-(aq)![]() H2O(l);ΔH=57.3KJ·mol-1
H2O(l);ΔH=57.3KJ·mol-1
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】Li-SO2充电电池具有高输出功率的优点。多孔碳电极可吸附SO2,电解液为溶解有LiBr的碳酸丙烯酯-乙腈溶液。下列说法错误的是( )
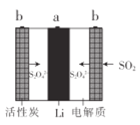
A.活性炭具有加快放电速率的作用
B.放电时,电子流向:a→溶液→b→a
C.充电时,阳极上发生的电极反应为:S2O42--2e-=2SO2
D.该电池的电解质溶液不能换成LiBr的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸和铜在加热时反应,生成SO2气体的体积为3.36L(标准状况下)。已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
(1)SO2气体的物质的量是多少?___
(2)参加反应的硫酸的物质的量是多少?___
(3)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究物质的性质和用途,需要对物质进行分离与提纯。根据下列信息回答问题。
(1)要从氯化钠和纯碱的混合物中分离出纯碱晶体可采取的方法是_______(填代号)
a.溶解,过滤 b. 溶解,蒸发结晶,过滤 c. 溶解,蒸发浓缩,降温结晶

(2)某同学设计的分离CO2和CO混合气体的实验。装置如图所示:

关闭b,打开a,混合气体通过该装置时,先得到的气体是_________,然后进行的操作是________________________,得到的气体是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是
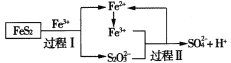
A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+
B.过程Ⅱ每生成1 mol SO42-转移8 mol e-
C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
D.反应过程中鼓入大量的空气有利于反应的进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)X的值等于__________;
(2)A的转化率为_________________。
(3)生成D的反应速率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
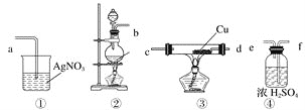
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”已成为各地的标牌。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式
①下列物质中可以吸收硫酸工业尾气的是___
a.饱和Na2SO3溶液 b.饱和NaCl溶液 c.稀H2SO4 d.浓氨水
②硫酸工业排出的尾气也可用软锰矿浆(主要成分为MnO2)吸收,生成MnSO4,写出反应的化学方程式___。
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___。
(3)用NaOH溶液亦可以吸收废气中的氮氧化物,化学方程式如下NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O
①上述两反应中分别消耗等量的NO2时,转移电子的物质的量之比为___。
②标准状况下5.6L混合气体(只有NO、NO2)被0.5molL﹣1NaOH溶液完全吸收,至少需要NaOH溶液的体积为___L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com