
【题目】向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8g的沉淀,则加入的NaOH溶液的体积可能为( )
A.150mLB.200mLC.700mLD.400mL
【答案】C
【解析】
若0.2molAlCl3中的Al3+完全沉淀,生成Al(OH)3,其质量![]() ,现在生成7.8g,即0.1mol Al(OH)3,说明存在两种情况;
,现在生成7.8g,即0.1mol Al(OH)3,说明存在两种情况;
①只生成7.8gAl(OH)3沉淀;根据方程式Al3++3OH-=Al(OH)3↓,生成0.1molAl(OH)3,消耗0.3molOH-,则需要NaOH-的体积![]() ;
;
①Al(OH)3完全沉淀,生成的沉淀再与OH-反应,发生溶解,剩余7.8gAl(OH)3沉淀,
第一步,Al3+完全沉淀,根据方程式Al3++3OH-=Al(OH)3↓,沉淀0.2molAl3+,需要0.6molOH-;第二步,Al(OH)3溶解0.1mol,根据方程式Al(OH)3+OH-=AlO2-+2H2O;溶解0.1molAl(OH)3,需要0.1molOH-;则总共消耗0.7molOH-,则需要NaOH的体积![]() ;C符合题意;
;C符合题意;
答案选C。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】下列化学方程式或电离方程式中,不能正确表达反应颜色变化的是
A.将氨气通入滴有酚酞试液的水中,溶液变红:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
B.少量FeCl3溶液滴入沸水中变为红褐色液体:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C.向CuCl2溶液中加入足量的铁粉,溶液由蓝色变为浅绿色:Fe+CuCl2=Cu+FeCl2
D.呼吸面具使用后,Na2O2由淡黄色逐渐变为白色:2Na2O2=2Na2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个化学兴趣小组,分别做乙醇催化氧化并验证产物的实验。甲组实验设计如图1所示,乙组实验设计如图2所示,密闭系统内空气很少。请填写下列空白:


(1)甲组要完成全部实验内容,以下步骤中正确的顺序是 _____ (填序号,步骤可重复)。
①加热 ②检查装置的气密性 ③向A中缓缓鼓入干燥的空气 ④取下D装置
(2)甲、乙两组实验中,给定的A~H中需要加热的是________(填编号)。
(3)反应开始后,C中观察到的现象是________。
(4)写出E中发生反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是
A.向待测液中先加入硝酸钡溶液有白色沉淀,再加入稀盐酸,白色沉淀不消失,可以确认待测液中含有SO![]()
B.向待测液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,可以确认待测液中含有NH![]()
C.向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认待测液中含有Fe2+
D.用玻璃棒蘸取待测液并在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计以下装置进行不同的实验。其中a为用于鼓入空气的气囊,b 为螺旋状铜丝,c中盛有冰水。

(1)若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是____________(填序号),该装置中应加入试剂____________。从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是____________。
(2)该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是____________(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是____________(填序号)。
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1 mL 2%的AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得。
设R为烃基,已知RX +Mg![]() R-MgX(格氏试剂)
R-MgX(格氏试剂)
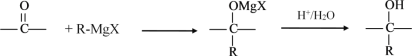
阅读以下合成路线图,回答有关问题:

(1)反应I的类型是____________,反应II的条件是____________。
(2)反应III的化学方程式为____________。
(3)E的同分异构体中,含有苯环且能发生银镜反应的有机物共有____________种。
(4)有机物![]() 是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
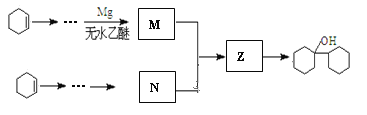
其中Z的结构简式为____________,用反应流程图表示以环己烯(![]() )为有机原料合成有机物N。____________
)为有机原料合成有机物N。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400K、101.3Kpa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下),若a=8时,该烃可能的分子式( )
A.CH4B.C2H6C.C3H8D.C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA-A键和1molB-B键,放出akJ能量
C.该反应中反应物的总能量高于产物的总能量
D.该反应热为(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
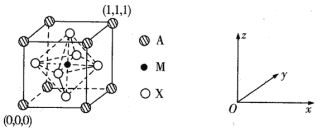
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com