
一定量的铜和浓硫酸在加热条件下充分反应:Cu+2H2SO4(浓)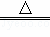 CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是()
CuSO4+SO2↑+2H2O.向反应后显酸性的溶液只能逐滴加入含amolNaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是()
A. 溶液中c(Na+)=2c(SO42﹣)
B. 沉淀的物质的量等于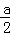 mol
mol
C. 标况下,生成SO2的体积<11.2aL
D. 原浓硫酸中H2SO4的物质的量>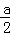 mol
mol
考点: 化学方程式的有关计算.
分析: A.滴加入NaOH溶液,恰好使反应后的溶液呈中性,溶液中溶质为硫酸钠溶液,根据电荷守恒判断;
B.硫酸有剩余,滴加入NaOH后溶液中c(Na+)=2c(SO42﹣),故硫酸铜的物质的量小于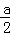 mol;
mol;
C.二氧化硫的物质的量等于硫酸铜物质的量,硫酸铜的物质的量小于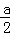 mol,再结构V=nVm计算判断;
mol,再结构V=nVm计算判断;
D.根据硫元素守恒:n(H2SO4)=n(Na2SO4)+n(SO2).
解答: 解:A.滴加入NaOH溶液,恰好使反应后的溶液呈中性,溶液中溶质为硫酸钠溶液,根据电荷守恒可知,溶液中c(Na+)=2c(SO42﹣),故A正确;
B.硫酸有剩余,滴加入NaOH后溶液中c(Na+)=2c(SO42﹣),则c(SO42﹣)=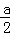 mol,溶液中硫酸根源于硫酸铜、剩余的硫酸,故硫酸铜的物质的量小于
mol,溶液中硫酸根源于硫酸铜、剩余的硫酸,故硫酸铜的物质的量小于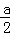 mol,故B错误;
mol,故B错误;
C.二氧化硫的物质的量等于硫酸铜物质的量,硫酸铜的物质的量小于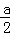 mol,故标况下生成二氧化硫的体积小于
mol,故标况下生成二氧化硫的体积小于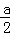 mol×22.4L/mol=11.2a L,故C正确;
mol×22.4L/mol=11.2a L,故C正确;
D.根据硫元素守恒:n(H2SO4)=n(Na2SO4)+n(SO2),滴加入NaOH后溶液中c(SO42﹣)=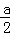 mol,故n(H2SO4)>
mol,故n(H2SO4)>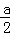 mol,故D正确,
mol,故D正确,
故选B.
点评: 本题考查化学方程式的有关计算,侧重对学生分析计算能力的考查,注意利用守恒法解答,难度中等.


科目:高中化学 来源: 题型:
已知SO3、BF3、CCl4、PCl5、SF6都是非极性分子,而H2S、NH3、NO2、SF4、BrF5都是极性分子,由此可推出ABn型分子属于非极性分子的经验规律是( )
|
| A. | ABn型分子中A、B均不含氢原子 |
|
| B. | A元素的相对原子质量必小于B元素的相对原子质量 |
|
| C. | 分子中所有原子都在同一平面上 |
|
| D. | ABn型的价层电子对数等于n |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 交叉分类法和树状分类法是化学上仅有的两种分类方法
B. 化合物中某元素处于最高价只能被还原
C. H2SO4在电流作用下在水中电离出H+和SO42﹣
D. 偏二甲肼(分子式:C2H8N2)是一种有机高能燃料,它的摩尔质量为60g
查看答案和解析>>
科目:高中化学 来源: 题型:
NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是()
A. NaNO2在反应中被氧化
B. NaI是还原产物
C. 若反应过程中转移2mole﹣,则生成标准状况下NO的体积为44.8L
D. 氧化剂与还原剂之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
在Na+浓度为0.5mol•L﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
阳离子 K+Ag+Mg2+Ba2+
阴离子 NO3﹣、CO32﹣、SiO32﹣、SO42﹣
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号 实验内容 实验结果
Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下0.56L气体
Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 固体质量为2.4g
Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象
请回答下列问题.
(1)实验Ⅱ,混合液过滤后如何洗涤沉淀? .
(2)澄清溶液中一定不存在的离子是 .
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写表中阴离子的物质的量浓度(能计算出结果的填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子 NO3﹣ CO32﹣ SiO32﹣ SO42﹣
c/mol•L﹣1 ?
(4)判断K+是否存在,若存在,求其最小浓度,若不存在,请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种元素的原子序数依次为a、b、c,它们的离An+、Bn﹣、Cm﹣具有相同的电子层结构,且n>m,则下列关系正确的是()
A. a>b>c B. a>c>b C. a=b+m﹣n D. a=c﹣n﹣m
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)﹣空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%﹣30%的KOH溶液.电池总反应为:N2H4+O2=N2↑+2H2O.下列关于该燃料电池工作时的说法正确的是()
A. 电池工作时,负极附近溶液的碱性增强
B. 正极的电极反应式是:O2+4H++4e﹣=2H2O
C. 负极的电极反应式是:N2H4+4OH﹣﹣4e﹣=4H2O+N2↑
D. 溶液中阴离子向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com