
【题目】X是一种日常生活中常见的金属,它既能与盐酸反应生成X3+和H2,又能与烧碱溶液反应生成XO2-和H2O.X的氢氧化物具有两性,但不与氨水反应;而Zn(OH)2与氨水反应生成[Zn(NH3)4]2+.试回答下列问题:
(1)X元素在元素周期表中的位置是______。
(2)X的氧化物也具有两性,写出其溶于烧碱溶液的离子方程式:_______。
(3)分离X3+与Zn2+的最佳方法是加入过量的____________。
(4)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,Z还可形成多种氢化物及其微粒,如Z2H4、Z2H5+、ZH4+等.
①写出Z2H4的电子式:________。
工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(Z2H4·H2O)、Na2CO3等产物,则该反应的化学方程式为_________。
查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜。取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在搞完下恰好完全反应生成氮气等产物,写出该反应的化学方程式:_______。
②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为______.
【答案】 第三周期第IIIA族 Al2O3+2OH-=2AlO2-+H2O 氨水 ![]() CO(NH2)2+NaClO+2NaOH=N2H4·H2O+Na2CO3+NaCl N2H4+6Fe2O3
CO(NH2)2+NaClO+2NaOH=N2H4·H2O+Na2CO3+NaCl N2H4+6Fe2O3![]() N2+4Fe3O4+2H2O NH4N3
N2+4Fe3O4+2H2O NH4N3
【解析】常见金属X,既能与盐酸反应生成X3+和H2,又能与烧碱溶液反应生成XO2-和H2O,X的氢氧化物具有两性,但不与氨水反应,该金属应该是Al;(1)Al元素在元素周期表中的位置是第三周期第IIIA族;(2)氧化铝属于两性氧化物,具有两性,与烧碱溶液反应生成偏铝酸钠和氢气,其反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;(3)氢氧化铝不溶于氨水,而氢氧化锌可以溶于氨水,分离Al3+与Zn2+的最佳方法是加入过量的氨水;(4)与O同周期的第VA族元素Z应该是N。①N2H4的电子式为:![]() ;工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等产物,根据质量守恒及氧化还原反应原理,生成物应该还有氯化钠和水,则该反应的化学方程式为:CO(NH2)2+NaClO+2NaOH=N2H4·H2O+Na2CO3+NaCl;肼与氧化铁在高温条件下反应生成氮气、水、铁单质,反应化学方程式为:N2H4+6Fe2O3
;工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等产物,根据质量守恒及氧化还原反应原理,生成物应该还有氯化钠和水,则该反应的化学方程式为:CO(NH2)2+NaClO+2NaOH=N2H4·H2O+Na2CO3+NaCl;肼与氧化铁在高温条件下反应生成氮气、水、铁单质,反应化学方程式为:N2H4+6Fe2O3![]() N2+4Fe3O4+2H2O;②若某一物质组成为Z4H4,Z为N元素,N4H4的一种离子化合物应该为铵盐,即NH4N3,叠氮化铵。
N2+4Fe3O4+2H2O;②若某一物质组成为Z4H4,Z为N元素,N4H4的一种离子化合物应该为铵盐,即NH4N3,叠氮化铵。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】工业上利用CO2和H2催化氢化可以制取甲烷。
(1)已知 ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH= -572 kJ·mol-1
③H2O(l)=H2O(g) ΔH= +44 kJ·mol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=a kJ·mol-1
CH4(g)+2H2O(g) ΔH=a kJ·mol-1
据此,a=_________;升高温度,该反应的v(逆)_____(填“增大”或“减小”)。
(2)在一定压强、不同温度下,两种催化剂分别催化CO2加氢甲烷化反应2h的结果如图1所示(一定温度下仅改变催化剂,其他条件不变):a、b-催化剂I; c、d-催化剂II。甲烷化选择性:指含碳产物中甲烷的物质的量分数。请据图1分析:
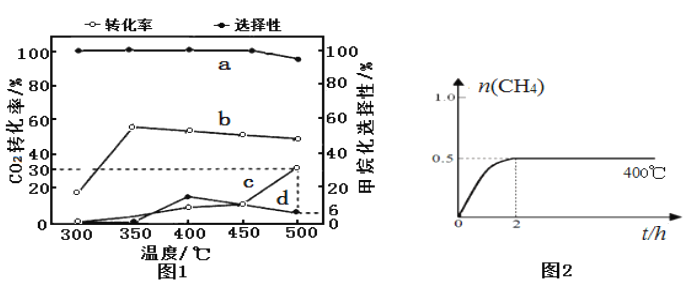
①催化剂I实验,400 ℃~450℃时CO2转化率下降的原因可能为___________(写1条)。
②催化剂II实验,检测密闭容器中产物发现,温度升高甲烷的选择性下降是发生了:CO2(g)+ H2(g)![]() CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
(3)下列与甲烷化反应有关的描述中,正确的是______:
A.单位时间内断裂1molC=O键的同时断裂1molC-H,说明该反应已达平衡
B.照上述反应使用催化剂,其Ⅰ的活化能比Ⅱ的活化能大
C.在绝热的密闭容器中进行时,当容器中温度不变时说明达到平衡
D.催化剂Ⅰ下,300-450℃内,选择性保持不变的主要原因是其它副反应的速率很慢
(4)催化剂I实验, 400℃时,向2L固定体积的密闭容器中通入1mol CO2和4mol H2,CH4物质的量随时间的变化趋势如图2时所示,则2h内H2平均反应速率为____________;平衡常数K=____________。若其他条件不变,反应在恒压条件下进行,请在图2中画出反应体系中n(CH4)随时间t变化的趋势图____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2H2(g)+O2(g)![]() 2H2O(l) ΔH=571.6 kJ·mol1,下列对于反应2H2O(l)
2H2O(l) ΔH=571.6 kJ·mol1,下列对于反应2H2O(l)![]() 2H2(g)+O2(g)的说法不正确的是
2H2(g)+O2(g)的说法不正确的是
A.吸热反应 B.ΔS>0
C.只能在电解条件下进行 D.在一定温度下可以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年11月30日至12月11日,世界各国领导人在巴黎共同商讨如何应对气候变化、提升经济绿色水平,实现人类可持续发展。要想提升经济绿色水平下列属于最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________。
(2)生产流程中加入过量铁屑的目的是___________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________;试设计实验证实该金属阳离子的存在:____________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铝粉,分别与等体积的氢氧化钠溶液和硫酸恰好完全反应,则氢氧化钠溶液和硫酸的物质的量浓度之比是( )
A.2:3B.3:2C.1:1D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH ![]() CH2=CH2↑+H2O.
CH2=CH2↑+H2O.
无水乙醇性质如表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
无水乙醇 | ﹣114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).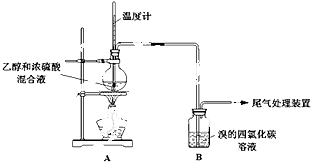
实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 |
… | |
实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)写出乙烯的1个用途: , 对应方程式为(注明反应类型) .
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型) .
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是(填化学式).
(5)为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; |
请回答下列问题:
D中盛放的试剂是(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释): .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com