
(14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g) ,在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g) ,在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:

则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H= +180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
(14分,每空2分) (1)< (1分) 0.75 (2) 26 K=c2(NH3)×c(CO2)
(3)C(s)+2NO(g)=CO2(g)+N2(g) △H= -574.1kJ·mol-1
(4)2NO2 + CO32- = CO2 + NO2— +NO3— ; C (Na+)> C (NO3—)> C (NO2—)> C (OH—)> C (H+)
【解析】
试题分析:(1)根据图像可知A点氨气的含量是变化的,这说明A点没有达到平衡状态,而B点达到平衡状态。A点到B点的氨气含量降低,这说明A点反应向正反应方向进行,正反应速率大于逆反应速率,则A点的逆反应速率V(逆)(CO2)小于 B点的正反应速率V(正)(CO2)。根据图像可知起始时氨气和CO2的体积相等,设物质的量均是1mol,消耗氨气的物质的量是xmol,则生成水蒸气的物质的量是0.5xmol。平衡时氨气的含量是0.2,则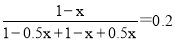 ,解得x=0.75,所以氨气的平衡转化率是0.75、
,解得x=0.75,所以氨气的平衡转化率是0.75、
(2)根据方程式可知生成的氨气和CO2的体积之比是2:1,则混合气体的平均相对分子质量是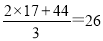 。由于只有生成物中有气体,则二者的体积之比是2:1,所以该反应的化学平衡常数的表达式为K=c2(NH3)×c(CO2)。
。由于只有生成物中有气体,则二者的体积之比是2:1,所以该反应的化学平衡常数的表达式为K=c2(NH3)×c(CO2)。
(3)已知:① N2(g)+O2(g)=2NO(g) △H= +180.6 kJ·mol-1,② C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1,则根据盖斯定律可知①—②即可得到炭粉还原一氧化氮的热化学反应方程式为C(s)+2NO(g)=CO2(g)+N2(g) △H= -574.1kJ·mol-1。
(4)9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,NO2的物质的量是0.2mol,这说明氮元素的化合价部分升高到+5价,另外一半降低到+3价,则此反应的离子反应方程式为2NO2 + CO32- = CO2 + NO2— +NO3— ;若生成的CO2完全逸出,由于亚硝酸根水解,溶液显碱性,则所得溶液中的离子浓度大小关系为C (Na+)> C (NO3—)> C (NO2—)> C (OH—)> C (H+)。
考点:考查平衡状态计算、平衡常数、盖斯定律应用以及氧化还原反应计算和离子浓度大小比较等


科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.氢化物的稳定性:X>Y>Z
D.四种元素的常见单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:填空题
(11分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,该反应的热化学方程式为 。
(2)298 K时,在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.3 mol·mol-1,n(N2O4)=0.6 mol·mol-1,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
我国发射载人航天飞船用于火箭启动炸药的是氕化锂、氘化锂和氚化锂,它们
A.都是共价化合物
B.都具有较强还原性
C.由同位素原子构成的同分异构体
D.微粒的半径H-小于Li+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省名校新高考研究联盟高三上学期联考化学试卷(解析版) 题型:选择题
化学与生产生活、环境保护、资源利用、能源开发等密切相关。下列说法错误的是
A.煤炭经气化、液化和干馏等过程,可以转化为清洁能源
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
D.高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:选择题
下列图中的实验方案,能达到实验目的的是
A | B | C | D | |
实验 方案 |
|
|
|
|
实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:填空题
(14分)铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生反应:2Cu+ =Cu2++Cu。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
(1)在新制Cu(OH)2悬浊液中滴入葡萄糖溶液,加热生成不溶物的颜色为: ,某同学实验时却有黑色物质出现,这种黑色物质的化学式为: 。
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:
a.2Cu2++4I- =2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I- =2CuCl↓(白色)+I2。
为顺利观察到白色沉淀可以加入的最佳试剂是 。
A.SO2 B.苯 C.NaOH溶液 D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5是离子晶体且所有原子都达到稀有气体的稳定结构,请写出NH5的电子式: 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式 。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式

(4)常温下,向0.20 mol ? L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=________________mol.L‑1。
[已知:
 ]
]
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
1.52g铜镁合金完全溶解于50mL 63%的浓硝酸(硝酸密度为1.40g/mL)中,得到标况下NO2和N2O4 的混合气体1120mL。向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
A.该合金中n(Cu):n(Mg)=2:1
B.合金完全溶解时,溶液中c(H+)=11.8mol/L(忽略反应前后溶液体积变化)
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
某学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的
A.氧化性:HClO>I2>SO42-
B.蓝色消失的原因是Na2SO3溶液具有漂白性
C.淀粉KI溶液变蓝是因为I-被HClO氧化为I2,I2遇淀粉变蓝
D.若将Na2SO3溶液加入氯水中,氯水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com