
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
分析 (1)依据实验步骤分析判断操作顺序,配制溶液,溶解样品,加入配制的过量盐酸溶液溶解碳酸钙,剩余的盐酸用氢氧化钠溶液滴定,计算反应的盐酸,通过碳酸钙和盐酸反应定量关系计算含量;
(2)过程中发生的反应为碳酸钙和盐酸是盐生成氯化钙、二氧化碳和水,氢氧化钠溶液和盐酸反应生成氯化钠和水;
(3)每次取用25.00 mL盐酸,4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL;
(4)依据消耗盐酸的物质的量计算反应的碳酸钙的物质的量计算得到质量分数;
(5)根据V(酸)=$\frac{c(碱)V(碱)}{c(酸)}$判断不当操作对相关物理量的影响,再根据与CaCO3反应的盐酸的体积=25ml-V(盐酸)以此判断误差.
解答 解:(1)依据实验步骤分析判断操作顺序,配制溶液,溶解样品,加入配制的过量盐酸溶液溶解碳酸钙,剩余的盐酸用氢氧化钠溶液滴定,计算反应的盐酸,通过碳酸钙和盐酸反应定量关系计算含量,测定过程的正确操作顺序为①②④③或②①④③;
故答案为:①②④③或②①④③;
(2)过程中发生的反应为碳酸钙和盐酸是盐生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;氢氧化钠溶液和盐酸反应生成氯化钠和水,反应的离子方程式为:H++OH-=H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O、H++OH-=H2O;
(3)每次取用25.00 mL盐酸,4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL,选择容量瓶250mL;
故答案为:250mL;4次需100 mL,因实验操作过程中需润洗滴定管、调液面、赶气泡等消耗HCl,故需用量要大于100 mL;
(4)第二次数据误差较大,应该省去,所以每片药剂平均耗NaOH溶液体积为$\frac{12.9mL+13.1mL+13.0mL}{3}$=13.0 mL,与CaCO3反应的盐酸的体积为:25.0 mL-13.0 mL=12.0 mL,则每片药剂中CaCO3的质量分数$\frac{12.0×10{\;}^{-3}L×0.100mol/L×100g/mol}{2×0.100g}$×100%=60.0%
故答案为:60.0%;
(5)①使用天平时左码右物测量值比实际值偏小,配成氢氧化钠溶液浓度偏低,滴定造成V(碱)偏大,根据V(酸)=$\frac{c(碱)V(碱)}{c(酸)}$,可知V(酸)偏大,则与CaCO3反应的盐酸的体积=25ml-V(盐酸)偏小,引起测量结果偏低,故①正确;
②滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失,则造成V(碱)偏大,根据V(酸)=$\frac{c(碱)V(碱)}{c(酸)}$,可知V(酸)偏大,则与CaCO3反应的盐酸的体积=25ml-V(盐酸)偏小,引起测量结果偏低,故②正确;
③中和滴定时,锥形瓶内有少量蒸馏水,对结果无影响,故③错误;
④滴定管用蒸馏水洗后,未用标准液洗,则氢氧化钠被稀释,造成V(碱)偏大,根据V(酸)=$\frac{c(碱)V(碱)}{c(酸)}$,可知V(酸)偏大,则与CaCO3反应的盐酸的体积=25ml-V(盐酸)偏小,引起测量结果偏低,故④正确;
⑤仰视刻度线则读数偏大,造成V(碱)偏大,根据V(酸)=$\frac{c(碱)V(碱)}{c(酸)}$,可知V(酸)偏大,则与CaCO3反应的盐酸的体积=25ml-V(盐酸)偏小,引起测量结果偏低,故⑤正确;
故选:①②④⑤.
点评 本题考查了物质组成应用,实验探究过程,步骤顺序和反应原理的理解应用和计算、误差分析,考查内容较多,难度中等,注意基础知识的积累.


科目:高中化学 来源: 题型:实验题
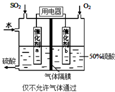 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75mL 2mol•L-1FeCl3溶液 | B. | 25mL 2mol•L-1KCl溶液 | ||
| C. | 150mL 1mol•L-1NaCl溶液 | D. | 20mL 1.5mol•L-1 MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g H2和8 gO2 | |
| B. | 0.1mol HCl 和2.24 L He | |
| C. | 150℃,1.01×105Pa时,18LH2O和18LCO2 | |
| D. | 常温常压下28gCO和6.02×1022个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X一定为电解质 | B. | X可能为NaCl | ||
| C. | X不能是酸类 | D. | X可以是任何化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
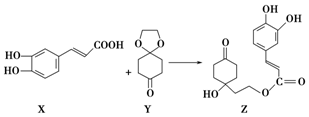
| A. | X的分子式为C9H8O4 | |
| B. | Y、Z中均含1个手性碳原子 | |
| C. | Z能发生加成反应、取代反应及消去反应 | |
| D. | 1 mol Z至多可与3 mol Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL | B. | 1000mL | C. | 100mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com