
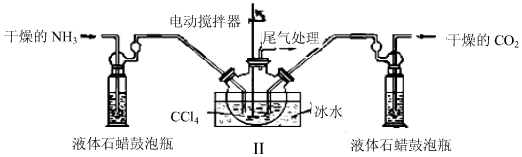
分析 (1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4;氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应;
(2)根据液体石蜡瓶鼓泡瓶中气泡控制气体流速和原料气体的配比;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O;
(5)①利用碳酸氢根与氯化钡没有沉淀生成,而与氢氧化钙溶液有沉淀生成可验证氨基甲酸铵的水解产物有HCO3-;
②生成的沉淀为碳酸钡,根据碳原子守恒、混合物总质量列方程各自物质的量,再计算氨基甲酸胺的质量,进而计算其物质的量分数.
解答 解:(1)由题目信息可知,氨气与二氧化碳反应生成NH2COONH4,反应方程式为:2NH3(g)+CO2(g)?NH2COONH4,
氨基甲酸胺易分解,图中反应装置用冰水冷却,防止氨基甲酸胺分解,说明制备氨基甲酸胺的为放热反应,
故答案为:2NH3(g)+CO2(g)?NH2COONH4;放热;
(2)可以根据液体石蜡瓶鼓泡瓶中气泡,控制气体流速和调节NH3与CO2通入比例,
故答案为:通过观察气泡,控制气体流速和调节NH3与CO2通入比例;
(3)由氨基甲酸胺小晶体悬浮在四氧化碳中,可以采取过滤方法分离,
故答案为:过滤;
(4)氨基甲酸胺极易水解,产物是碳酸氢铵和一种弱碱,该弱碱为NH3•H2O,反应方程式为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,
故答案为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O;
(5)①利用碳酸氢根与氯化钡没有沉淀生成,而与氢氧化钙溶液有沉淀生成可验证氨基甲酸铵的水解产物有HCO3-,实验设计方案为:取少量固体样品于试管中,加入蒸馏水至固体溶解,得到无色溶液,加入过量的BaCl2溶液,静置,取上层清液于另一试管,向试管中继续加入少量澄清石灰水.溶液变浑浊,说明氨基甲酸铵水解产物有碳酸氢根,
故答案为:加入过量的BaCl2溶液,静置,取上层清液于另一试管,向试管中继续加入少量澄清石灰水.溶液变浑浊,说明氨基甲酸铵水解产物有碳酸氢根;
②生成的沉淀为碳酸钡,其物质的量为:$\frac{1.97g}{197g/mol}$=0.01mol,
氨基甲酸铵物质的量为x,碳酸氢铵物质的量为y,
由碳元素守恒可知:x+y=0.01
由质量可得:78x+79y=0.782
解得x=0.008mol,y=0.002mol,
则制得的样品中氨基甲酸胺的物质的量分数为:$\frac{0.008mol}{0.01mol}$×100=80.0%,
故答案为:80.0%.
点评 本题考查物质制备实验、化学反应速率影响因素、物质含量测定、化学与技术等,题目难度中等,把握反应原理为解答的关键,侧重分析与实验能力的考查,综合性较强.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉的最简式:CH2O | B. | 邻羟基苯甲酸的结构简式: | ||
| C. | 2-乙基-1,3-丁二烯的键线式: | D. | 苯分子球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
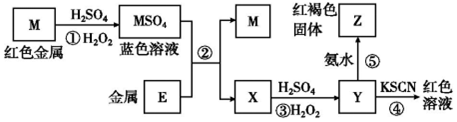
| A. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| B. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| C. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| D. | 红褐色固体Z不能溶于氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com