
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2∶3
③SiO2+3C![]() SiC+2CO↑;1∶2
SiC+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
A.①③B.②③
C.②④D.①④
【答案】B
【解析】
①反应KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,氧化剂为KClO3,还原剂为HCl,根据电子转移数目守恒可知,反应中氧化剂与还原剂的物质的量之比为1∶5,故①错误;
②反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,氧化剂为HNO3,但8mol硝酸参与反应只有2molN的化合价发生降低,所以参加反应的氧化剂为2mol,还原剂为Cu,参加反应的氧化剂与还原剂物质的量之比为2∶3,故②正确;
③反应SiO2+3C═SiC+2CO↑中,氧化剂为C,还原剂为C,C元素化合价由0价降低为-4价,由0价升高为+2价,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为1∶2,故③正确;
④反应3NO2+H2O═2HNO3+NO,NO2为既是氧化剂,又是还原剂,参加反应的氧化剂与还原剂物质的量之比为1∶2,故④错误;
故选B。


科目:高中化学 来源: 题型:
【题目】I.某化学兴趣小组在实验室用如下装置制备氯气:

请回答:
(1)写出A装置中制取氯气的化学方程式____________________。
(2)若要制备纯净、干燥的氯气,需在A、B之间添加净化装置D、E,其中导管连接的顺序是____________________ (填写数字编号)。
II.某化学实验室产生的废液中含有Fe3+、Cu2+、Ag+三种金属离子,实验室设计了方案对废液进行以下三步处理,并回收金属。

请回答:
(1)步骤①中得到的沉淀含有的金属单质有__________。
(2)步骤②是将Fe2+转化为Fe3+,还可以选用的试剂是_____。
A.Fe粉 B.NaOH溶液 C.新制氯水 D.稀硫酸
(3)步骤③中加入氨水生成红褐色沉淀的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示,回答下列问题:

(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有______任写两种)。
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是________。
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为__________,需要加入Na2CO3粉末的目的是__________________________________________。
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH____________时,才能使所得的FeCO3中不含Fe(OH)2。(已知:Ksp[FeCO3] = 3.0×10-11,Ksp[Fe(OH)2] = 1.0×10-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金晶体的最小重复单元(也称晶胞)是面心立方体,如图所示,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。请回答下列问题:
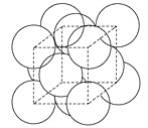
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定_______________。
(3)一个晶胞的体积是____________。
(4)金晶体的密度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
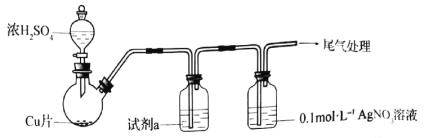
①浓H2SO4与Cu反应的化学方程式是____________________________________。
②试剂a是____________。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。
(3)根据沉淀F的存在,推测![]() 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,![]() 被氧化为
被氧化为![]() 进入D。
进入D。
实验三:探究![]() 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。
②实验三的结论:__________。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和![]() 生成。
生成。
(6)根据上述实验所得结论:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:

(1)A的名称是__________,B中含碳官能团的结构式为__________。
(2)反应③的有机反应类型是__________。
(3)下列说法正确的是(_____)
A. 1mol E与足量的新制氢氧化铜悬浊液反应能生成1molCu2O
B. F能与NaHCO3反应产生CO2
C. 反应①发生的是消去反应
(4)写出E与银铵溶液反应的化学方程式________________________________________。
(5)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有_______种;请写出其中任意两种________________________________________________。
的同分异构体中同时符合下列条件的芳香族化合物共有_______种;请写出其中任意两种________________________________________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
(6)写出反应⑤的化学方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
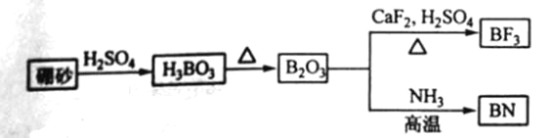
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是

A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com