
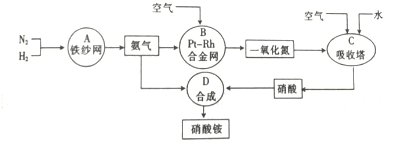
分析 (1)工业制氮气的原理是分离液态空气,其方法是将空气加压降温成液态空气,然后略微升温,沸点低的先逸出;
(2)①NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,Cl元素的化合价降低;
②肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,据此书写化学方程式;
(3)氢叠氮酸(HN3)只由两种元素构成,故受撞击时爆炸分解成常见的两种单质为氢气和氮气,据此书写反应;
(4)根据反应中各物质的组成元素的化合价是否发生变化来判断是否发生氧化还原反应.
解答 解:(1)氧气的沸点是-183℃,氮气的沸点是-196℃,工业制氮气的原理是分离液态空气,其方法是将空气加压降温成液态空气,然后略微升温,沸点低的氮气先逸出,此方法为液态空气的分馏,
故答案为:分馏;
(2)①NH3与NaClO反应可得到肼(N2H4),N元素的化合价升高,Cl元素的化合价降低,则NaClO氧化剂;
故答案为:NaClO;
②肼和亚硝酸(HNO2)反应时发生归中反应生成氢叠氮酸(HN3),H和O元素未发生氧化还原反应,故化学方程式为N2H4+HNO2═HN3+2H2O,
故答案为:N2H4+HNO2═HN3+2H2O;
(3)氢叠氮酸(HN3)只由两种元素构成,故受撞击时爆炸分解成常见的两种单质为氢气和氮气,故化学方程式为:2HN3=H2↑+3N2↑,
故答案为:2HN3=H2↑+3N2↑;
(4)题中涉及的化学反应有:A、N2+3H2?2NH3,B、4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,C、2NO+O2═2NO2、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3,D、NH3+HNO3═NH4NO3,其中A、B、C属于氧化还原反应,
故答案为:ABC.
点评 本题考查了氧化还原反应的判断、化学方程式的书写等知识,题目难度稍大,试题题量较大,涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
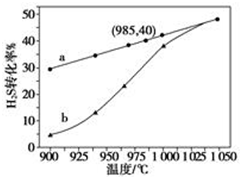 在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.
在恒容密闭容器中,控制不同温度进行H2S分解实验:2H2S(g)?2H2(g)+S2(g),以H2S起始浓度均为c mol•L-1测定H2S的转化率,结果见图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=$\frac{0.8c}{9}$;说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需的时间缩短.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
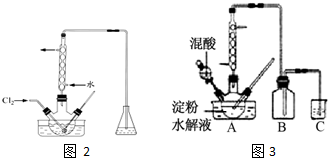
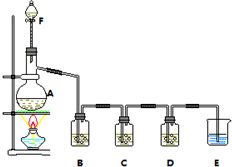 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
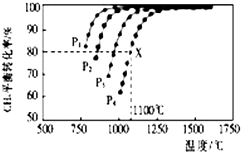 在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.
在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
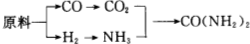

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
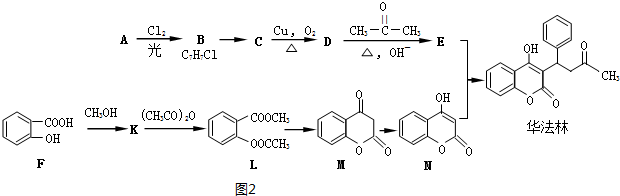
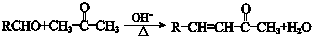
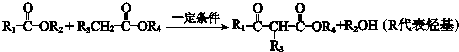
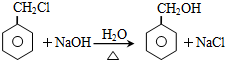 ;
; .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.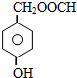 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com