
下图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略)。

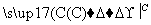
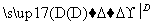

以下判断不正确的是( )
A.若A是AlCl3,则C既可以是强碱,也可以是弱碱
B.若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应
C.若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂
D.上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物
科目:高中化学 来源: 题型:
硫酸、硝酸与盐酸是工业上常用的三大强酸。工业上制备硫酸常用接触法,工业上制硝酸是用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A.在沸腾炉中进行的反应为:4FeS2+11O2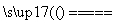 2Fe2O3+8SO2
2Fe2O3+8SO2
B.氨被氧气催化氧化:4NH3+5O2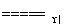 4NO+6H2O
4NO+6H2O
C.硫酸工业、硝酸工业都需要对工业尾气进行处理
D.接触法制硫酸的原料为:二氧化硫、空气、水
查看答案和解析>>
科目:高中化学 来源: 题型:
相同条件下,O4是意大利的一位科学家合成的一种新型的氧分子,一个分子由四个氧原子构成,振荡会发生爆炸,在相同条件下,关于等质量的O4和O3比较正确的是( )
|
| A. | 所含原子数相等 | B. | 密度之比1:1 | C. | 体积之比1:1 | D. | 分子数之比4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在实验室用如图所示装置探究氮氧化物气体与烧碱溶液的反应。实验过程中将胶头滴管中的液体挤入烧瓶,若碱液可快速、充分吸收产生的氮氧化物气体。下列叙述正确的是( )
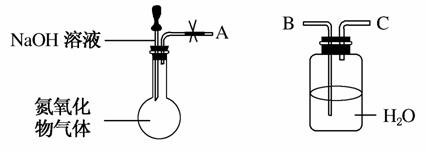
A.若将A与B连接,打开止水夹,则广口瓶中长导管口有气泡产生
B.若将A与C连接,打开止水夹,水沿导管由广口瓶进入烧瓶中
C.无论A连接B还是C,打开止水夹,均无明显现象
D.若将NaOH溶液换为水,可以用这套装置验证氨气易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母,)原因是________________________________________________________________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________________________________________________________________________________________________________________________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是______________________________________________ _____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________________________________________________________________________________________________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________________________________________________________________。
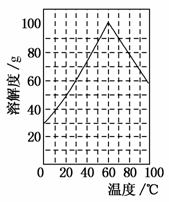
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合上图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,__________________________________________________________________________________________________________________________________,得到FeSO4溶液,_________________________________ _____________________________________________,得到FeSO4·7H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃)
(1)电解精炼银时,阴极反应式为__________________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________________________________________________ ________________________________________________________________________________________。
(2)固体混合物B的组成为________;在生成固体B的过程中,需控制NaOH的加入量。若NaOH过量,则因过量引起的反应的离子方程式为________________________________________________________________________。
(3)完成煅烧过程中一个反应的化学方程式:________CuO+______Al2O3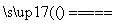 ______CuAlO2+______↑。
______CuAlO2+______↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
氡是放射性稀有气体元素,氡气吸入体内有害健康,氡的核电荷数是86,相对原子质量是222。科学家还发现某些放射性矿物分解放出的“锕射气”,是由质子数86,质量数219的原子组成,下列有关氡的说法正确的是
A.氡气在标准状况下密度约是19.82g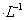
B.氡气化学性质较活泼,因此对人体有害
C.氡原子核外有7个电子层,最外层有8个电子
D.“锕射气”是氡的同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
利用碳-碳偶联反应合成新物质是有机合成的研究热点之一,如:

化合物Ⅰ可以由以下合成路线获得:

(1)化合物Ⅰ的分子式为 。
(2)化合物Ⅱ与Br2的CCl4溶液发生加成反应,产物的结构简式为______________________。
(3)化合物Ⅲ生成化合物Ⅰ的化学方程式为_____________;(注明反应条件)
(4)化合物Ⅳ是化合物Ⅲ的一种同分异构体,其苯环上只有一种取代基,Ⅳ的催化氧化产物Ⅴ能发生银镜反应。Ⅳ的结构简式为_____________,Ⅴ的结构简式为_____________。
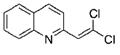
(5)有机物 与BrMgCH2(CH2)3CH2MgBr在一定条件下发生类似反应①的反应,生成的有机化合物Ⅵ(分子式为C16H17N)的结构简式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com