
| A、CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成 |
| B、在常温下,Na2CO3+2HCl═2NaCl+CO2↑+H2O,说明HCl酸性强于H2CO3;在高温下,Na2CO3+SiO2═Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3 |
| C、H2SO4为强酸,推出HClO4为强酸 |
| D、NH3的沸点高于PH3,推出CH4沸点高于SiH4 |


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、C02、CS2、SO2都是直线型的分子 |
| B、COCl2、SF6、CO32-都是平面三角型的分子 |
| C、BF3分子的键角大于CH4分子的键角 |
| D、PCl3、NH3、BCl3都是三角锥形的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶质的质量分数为ω=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5ω |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 NaCl与0.05 mol?L-1 Na2CO3溶液中的Na+数目 |
| B、质量相等的金刚石与C60中的碳原子数目 |
| C、标准状况下,等体积的SO2与SO3的分子数目 |
| D、28 g乙烯气体和56g环丁烷(C4H8)气体中含有的碳原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2=Ca2++2Cl- |
| B、NaHSO4=Na++H++SO42- |
| C、HNO3=H++NO3- |
| D、KOH=K++O2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是
I.科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
| 项目 | pH | Ca2+、Mg2+总浓度 | 细菌个数 |
| 相关值 | 6.5~8.5 | <0.0045mol?L-1 | <100个?mL-1 |
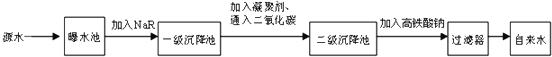
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com