
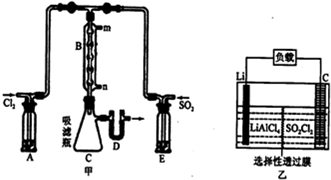
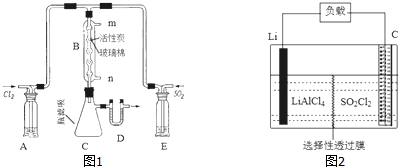
分析 (1)①根据常见仪器的名称来解答;
②a.根据饱和食盐水和饱和NaHSO3溶液起不到干燥的作用判断;
b.D处U形管中盛放的固体干燥剂判断;
c.根据B处反应管冷却水应低处进高处出判断;
d.根据反应放热,则装置C处吸滤瓶应放在冰水中冷却有利于利平衡正向移动判断;
③根据温度降低,平衡正向移动来解答;
(2)由方程式可知P4+10 SO2Cl2=4PCl5+10SO2↑可知P4~10SO2~20mole-,由此分析解答;
(3)SO2Cl2遇水发生剧烈水解,根据水解原理可知为H-与Cl-结合生成HCl,-SO2-基团结合2个-OH生成H2SO4;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,据此书写.
解答 解:(1)①A的仪器名称是洗气瓶,故答案为:洗气瓶;
②a.A、E处洗气瓶,干燥吸水,二氧化硫和氯气都可以用浓硫酸干燥,而饱和食盐水和饱和NaHSO3溶液起不到干燥的作用,故a错误;
b.D处U形管中盛放的固体干燥剂,可能是固体碱石灰,故b正确;
c.B处反应管冷却水应低处进高处出,所以从n接口通入,故c错误;
d.装置C处吸滤瓶应放在冰水中冷却,由利于平衡正向移动,更有利于SO2Cl2的收集,故d正确;
故选bd;
③温度降低,平衡正向移动,SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,正反应是放热反应,所以水冷却利于SO2Cl2的合成;
故答案为:冷凝SO2Cl2;降低温度平衡右移,有利于与SO2Cl2的生成;
(2)由方程式可知P4+10 SO2Cl2=4PCl5+10SO2↑可知P4~10SO2~20mole-,所以生成1molSO2,则转移电子的物质的量为2mol,故答案为:2;
(3)SO2Cl2遇水发生剧烈水解,生成HCl和H2SO4,反应方程式为:SO2Cl2+2H2O=H2SO4+2HCl,故答案为:SO2Cl2+2H2O=H2SO4+2HCl;
(4)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查了物质制备、氧化还原的相关计算、化学方程式的书写、平衡移动和电极反应式的书写等,难度不大,注意理解制备的原理是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 可以用Na0H溶液除去溴苯中的杂质 | |
| C. | 用酸性KMnO4溶液可以除去乙烯中混有的乙炔 | |
| D. | 实验室提纯混有少量乙酸的乙醇,可以采用先加石灰石,过滤后再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.
己知A,B、C、D,E五种元素的原子序数依次增大,A元素位于周期表的s区.其原子中电子层数等于未成对电子数:B的基态原子中电子占据三种能量不同的原子轨道,且每种原子轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3 倍. A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,AB两种元素成的原子个数之比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+和氩原子的核外电子抹布相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VA=0.15mol/(L•min) | B. | VB=0.6mol/(L•min) | ||
| C. | VC=0.4mol/(L•min) | D. | VD=0.6mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在蒸馏的实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 | |
| B. | 用直接蒸馏的方法可以得到无水乙醇 | |
| C. | 在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 | |
| D. | 作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com