
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某化学研究性学习小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕):
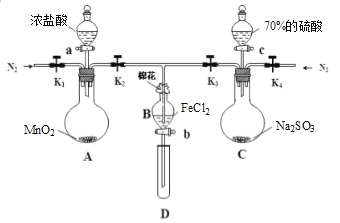
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是__________________________________________________________。
(2)棉花中浸润的溶液为________________,作用是_____________________________________________ 。
(3)A中发生反应的化学方程式________________________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是________________________________________,用________(写试剂化学式)检验氧化产物,现象是____________________________________________ 。
(5)能说明氧化性Fe3+>SO2的离子方程式是_______________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性:Cl2>Fe3+>SO2的是_______(填“甲”“乙”“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可通过下列流程回收废旧锂离子电池正极材料(LiCoO2,含少量Al、Fe)中的钴和锂。
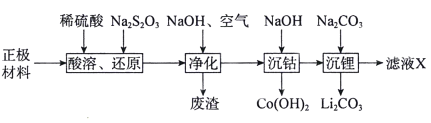
回答下列问题:
(1)“酸溶、还原”过程中S2O32-转化为SO42-,LiCoO2参与反应的离子方程式为____________________________________。
(2)“废渣”的主要成分为___________________。
(3)“沉钴”过程中,当溶液的pH=10时,c(Co2+)=______mol· L-1(已知常温下KSP[Co(OH)2]=1.58×10-15)。
(4)在空气中加热Co(OH)2,固体残留率随温度的变化如图所示。

290℃时,完全脱水变为Co2O3,反应的化学方程式为_______________;500℃时的主要产物为_____________(填化学式);将1000℃时的分解产物1mol与2.2mol Na2O(稍过量)在充氩封闭管中共热,会生成鲜红色的晶体,该晶体的阴离子为正三角形结构,晶体的化学式为__________________。
(5)“滤液X”中最主要的溶质是_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。下列说法错误的是( )

A.装置A烧瓶内的试剂可以是KMnO4
B.装置B具有除杂和贮存气体的作用
C.实验结束后,振荡D会观察到液体分层且下层呈紫红色
D.利用该装置能证明氯、溴、碘的非金属性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中正确的是( )
A.已知2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
2H2O(g) ΔH=-483.6 kJ/mol,则1mol氢气燃烧放出热量为483.6 kJ
B.由C(石墨,s)![]() C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,石墨比金刚石稳定
C.同温同压下,H2(g)+Cl2(g)![]() 2HCl(g)在光照和点燃条件的ΔH不同
2HCl(g)在光照和点燃条件的ΔH不同
D.化学变化不一定都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
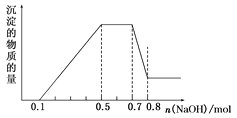
A.溶液中一定不含CO32-,可能含有SO42-和NO3-
B.在滴加NaOH溶液物质的量为0.5~0.7mol时,发生离子反应为Al3++4OH-=AlO2-+2H2O
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+)=2∶4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,反应速率最快的是( )
A. υ (C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院大连化学物理研究所的一项最新成果实现了甲烷高效生产乙烯,如图所示,甲烷在催化作用下脱氢,在不同温度下分别形成![]() 等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)
等自由基,在气相中经自由基:CH2偶联反应生成乙烯(该反应过程可逆)

物质 | 燃烧热/(kJmol-1) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.0 |
(1)已知相关物质的燃烧热如上表所示,写出甲烷制备乙烯的热化学方程式______________。
(2)现代石油化工采用Ag作催化剂,可实现乙烯与氧气制备X(分子式为C2H4O,不含双键)该反应符合最理想的原子经济,则反应产物是____________(填结构简式)
(3)在400℃时,向初始体积为1L的恒压密闭反应,器中充入1 mol CH4,发生(1)中反应,测得平衡混合气体中C2H4的体积分数为25.0%。则:

①在该温度下,其平衡常数KC=____________。
②若向该反应器中通入高温水蒸气(不参加反应,高于400℃),则C2H4的产率____________。(填“增大”“减小”“不变”或“无法确定”),理由是_______________________________。
③若反应器的体积固定,不同压强下可得变化如右图所示,则压强P1,P2的大小关系是____________。

(4)实际制备C2H4时,通常存在副反应2CH4(g)![]() C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
C2H4(g)+2H2(g)。反应器和CH4起始量不变,不同温度下C2H6和C2H4的体积分数与温度的关系曲线如右图所示。在温度高于600℃时,有可能得到一种较多的双碳有机副产物的名称是____________。
(5)C2H4、C2H6常常作为燃料电池的原料,请写出C2H4在NaOH溶液中做燃料电池的负极的电极反应方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。下列说法错误的( )
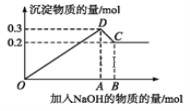
A.C点溶液中溶质为偏铝酸钠和氯化钠
B.原溶液中Mg2+、Al3+的物质的量浓度之比为 2∶1
C.C点加入0.8mol NaOH
D.图中线段OA∶AB=5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com