
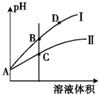
分析 (1)等体积混合生成Na2A,水解显碱性,离子水解以第一步为主;
(2)①弱酸电离,②中水解生成分子,③中等体积混合为等量的NaCl、NaHA、H2A,浓度均为0.01mol/L,抑制弱酸的电离;
(3)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,以此分析;
(4)由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp可得c(Ba2+).
解答 解:(1)存在的分子有H2O、H2A,则H2A为弱酸,等体积混合生成Na2A,水解显碱性,pH>7,
故答案为:>;
(2)①弱酸电离,②中水解生成分子,③中等体积混合为等量的NaCl、NaHA、H2A,浓度均为0.01mol/L,抑制弱酸的电离,则三种情况的溶液中H2A分子浓度最大的为③,最小的为②,②溶液pH大于③,①③相比①的酸性强,则pH最小,所以②>③>①,
故答案为:③;②>③>①;
(3)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量,
故答案为:D;
(4)由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp=c(Ba2+)•c(A2-)可得c(Ba2+)=$\frac{Ksp}{c({A}^{2-})}$=$\frac{1.8×1{0}^{-10}}{\frac{1}{3}}$=5.4×10-10 mol•L-1;
故答案为:5.4×10-10.
点评 本题考查较综合,涉及酸碱混合的定性分析、pH、电离与水解、电离方程式等,把握溶液中的溶质及电离与水解的趋势、相互影响即可解答,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素金属性:Z>W | |
| B. | X与Y可形成多种共价化合物 | |
| C. | 化合物Z2Y2中既含离子键,又含共价键 | |
| D. | Y元素只能形成一种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
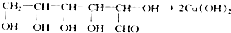 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$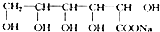 +Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒
+Cu2O+3H2O.实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯、胶头滴管外,还需要漏斗、玻璃棒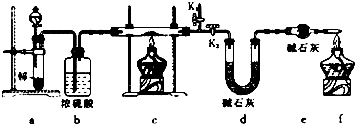
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.
已知H2CO3的Ka1=4.2×10-7、Ka2=5.6×10-11;HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | C( F-)<C(CN-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com