
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,用途十分广泛。它可以作净水剂,在无机化学工业中,它是制取其它铁化合物的原料。
【査阅资料】隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
【实验探究】某化学小组选用下图所示部分装置进行实验(部分夹持装置略)
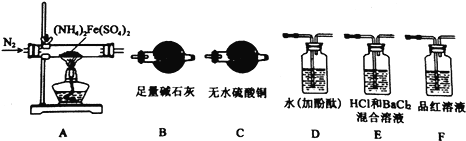
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为(________)。
A.A-B-C-D B.A-C-B-D C.A-D-B-C D.A-D-C-B
②取A中残留固体,加入适量稀硫酸,使其完全溶解得到溶液B,下列哪组实验能够证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4(________)
A.向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色
B.向溶液B中加入苯酚,溶液呈紫色
C.向溶液B中通入足量氯气,加入硫氰酸钾溶液变红色
D.向溶液B中加入铁氰化钾溶液,无现象
(2)探究分解产物中的硫氧化物,连接装置A—E—F—B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出该硫化物是__________。
②实验证明(NH4)2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式________。
【答案】 B AD SO2 2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O
【解析】(1)①验证分解产物中含有氨气和水蒸气,选择装置A先通入氮气排净装置中的空气,加热分解硫酸亚铁铵,分解产物中含有铁的氧化物、硫氧化物、氨气和水蒸气等,通过装置C中无水硫酸铜检验生成的水,再通过装置B中的足量碱石灰除去水蒸气、硫的氧化物,通过装置D检验氨气的生成,通入后溶液变红色说明生成气体中还有氨气,因此所选用装置的正确连接顺序为A-C-B-D,答案选B;②根据亚铁离子具有还原性可以使酸性高锰酸钾溶液褪色设计或利用铁氰化钾检验,即向溶液B中滴加酸性高锰酸钾溶液,高锰酸钾溶液不褪色,则残留固体是Fe2O3而不含FeO和Fe3O4,或向溶液B中加入铁氰化钾溶液,无现象,答案选AD;(2)①E中为含HCl的BaCl2溶液没有明显现象,说明没有硫酸钡沉淀生成,证明分解产物中无三氧化硫生成,二氧化硫具有漂白性能使品红溶液褪色,F中溶液褪色说明有二氧化硫生成;②实验证明(NH4)2Fe(SO4)2受热分解生成氨气、二氧化硫、氧化铁、水,还有N2产生,结合原子守恒和电子守恒配平该反应的化学方程式为2(NH4)2Fe(SO4)2![]() Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O。
Fe2O3+4SO2↑+2NH3↑+N2↑+5H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步实验直接完成的是
A. Al(OH)3→Al2O3 B. Al2O3→Al(OH)3 C. Al→Al2O3 D. AlCl3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
![]()
该反应在研究新型发光材料、超分子化学等方面具有重要价值。如图是用利用Glaser反应制备化合物E的一种合成路线:
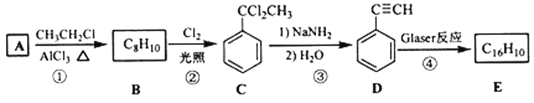
回答下列问题:
(1)B的化学名称为______________________________。
(2)③的反应类型为_________________________________。
(3)E的结构简式为__________________________________________________。用1 mol E合成1,4-二苯基丁烷,理论上需要消耗氢气________________________________mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________________________________________________________________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为____________________________________________________________________________________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中2种的结构简式_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或说法正确的是( )
A. 甲烷的燃烧热为ΔH=-890 kJ·mol-1 ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知:H2(g)+F2(g)=2HF(g) ΔH=-270 kJ·mol-1 ,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D. 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是( )
A. 是否是大量分子或离子的集合体 B. 分散质粒子的大小
C. 是否能通过滤纸 D. 是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是
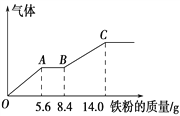
A. 原混合酸中HNO3的物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+ == 3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置. 
(1)写出下列仪器的名称:a.b.c. .
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 , 将仪器补充完整后进行实验,温度计水银球的位置在处.冷凝水由(填f或g)口通入.
(3)现需配制0.1mol/L CuSO4溶液450mL,装置II是某同学转移溶液的示意图.
①图中的错误是 . 除图中给出的仪器和分析天平外,为完成实验还需的仪器有: .
②根据计算得知,需称取的胆矾的质量为g.
③在100mL某浓度的CuSO4溶液中加入一质量为45.0g的铁棒,反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g.若反应后溶液的体积不变,所得溶液中FeSO4的物质的量浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com