
| A、c (HCN)<c (CN-) |
| B、c (Na+)>c (CN-) |
| C、c (HCN)-c (CN-)=c (OH-) |
| D、c (HCN)+c (CN-)=0.1mol?L-1 |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
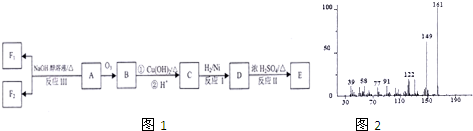
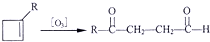
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 400℃ | 500℃ | 800℃ | 1000℃ |
| 平衡常数 | 10 | 9 | 1 | 0.5 |
| 4 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制水泥和玻璃都用石灰石作原料 |
| B、硫和氮的氧化物大量排放都可能引起酸雨 |
| C、二氧化硅是光纤制品的主要化学成分 |
| D、食用加碘盐可防治核辐射对人体的伤害 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将电源反接前a极发生的反应为:2H++2e-=H2↑ |
| B、将电源反接后,a极发生的反应只有Cu2++2 e-=Cu |
| C、整个电解过程只产生一种气体 |
| D、原硫酸铜溶液的浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水稀释 |
| B、加少量NaOH |
| C、加适量氢碘酸 |
| D、通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
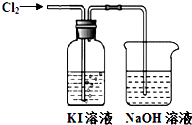 某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:
某同学对Cl2与KI溶液的反应进行了实验探究.反应装置如下:| 操作 | 实验现象 | |
| a | 取2~3 mL黄色溶液,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层显浅黄色. |
| b | 取2~3 mL饱和碘水,加入足量CCl4,振荡静置. | CCl4层呈紫红色,水层几近无色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com