
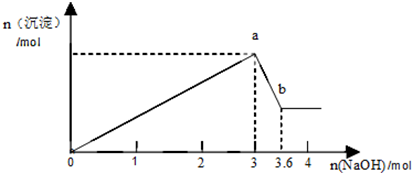
分析 生成沉淀发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,沉淀减少发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,由图可知,溶解氢氧化铝消耗NaOH为0.6mol,可知沉淀量最大时Al(OH)3是0.6mol,再结合沉淀量最大时消耗NaOH计算FeCl3的物质的量,进而计算FeCl3的物质的量浓度.
解答 解:(1)生成沉淀发生反应:FeCl3+3NaOH=Fe(OH)3↓+3NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,故a点对应的沉淀为:Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(2)由图可知,溶解氢氧化铝消耗NaOH为3.6mol-3mol=0.6mol,则:
Al(OH)3+NaOH=NaAlO2+2H2O
0.6mol 0.6mol
故沉淀达到最大值时生成的Al(OH)3的质量是0.6mol×78g/mol=46.8g
答:沉淀达到最大值时生成的Al(OH)3的质量是46.8g;
(3)由AlCl3+3NaOH=Al(OH)3↓+3NaCl,可知生成0.6molAl(OH)3消耗NaOH为0.6mol×3=1.8mol,
沉淀量最大时消耗NaOH为3mol,则生成Fe(OH)3时消耗NaOH为3mol-1.8mol=1.2mol,
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
0.4mol 1.2mol
故FeCl3的物质的量浓度为$\frac{0.4mol}{0.1L}$=4mol/L,
答:原混合液中FeCl3的物质的量浓度为4mol/L.
点评 本题考查混合物有关计算,明确各阶段发生的反应是解题关键,侧重考查学生分析计算能力,难度中等.


科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚遇石蕊显红色 | B. | 包装用材料聚氯乙烯属于烃 | ||
| C. | 食用花生油能发生水解反应 | D. | PX项目中的对二甲苯属于饱和烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑥⑨ | B. | ①②③④ | C. | ⑥⑦⑧⑨ | D. | ③④⑤⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 标准状况下,4.0 g CH4中含有共价键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝为负极,镁为正极 | B. | 正极反应式为2H++2e-═H2↑, | ||
| C. | 放电时间越长,溶液中c(H+)越小 | D. | 电解质溶液不可能是硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com