
【题目】下列说法正确的是( )
A. 非金属氧化物一定为酸性氧化物
B. 分解反应一定有单质生成
C. 向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D. “忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl﹣和ClO﹣)的比值与反应的温度有关,用40gNaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
(1)NaOH溶液的物质的量浓度molL﹣1;
(2)某温度下,反应后溶液中c(Cl﹣)=6c(ClO﹣),则溶液中c(ClO﹣)=molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的反应A(g)+3B(g)![]() 2C(g),下列叙述不能表明该反应达到化学平衡状态是
2C(g),下列叙述不能表明该反应达到化学平衡状态是
A. C的生成速率与C的分解速率相等 B. 混合气体的总物质的量不再变化
C. A、B、C的浓度不再变化 D. 单位时间内生成a molA,同时分解2amolC
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。使Ba(OH)2·8H2O与NH4Cl充分反应。实验中观察到的现象是______________________,说明该反应是___________热反应,这是由于反应物所具有的总能量_________ (填“大于”、“小于”或“等于”生成物所具有的总能量。
(2)将Fe+2FeCl3=3FeCl2设计为一个原电池,则该电池的负极材料为__________,正极电极反应式为__________________________________。
(3)恒温下,将amo1N2与bmolH2的混合气体通入一容积固定的密闭容器中,发生如下反应:N2(g)+ 3H2(g)![]() 2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在容器为1L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:
2NO2(g),且温度升高,混合气体的颜色加深。100℃时,体系中各物质的浓度随时间的变化如图15所示。回答下列问题:

(1)100℃时,在0~60s时段,反应速率v(N2O4)为______mol/(L·s),反应的平衡常数K为_______。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol/(L·s)平均速率降低,经10s又达到平衡.T_____100℃(填“大于”或“小于”),判断理由是_________。
II.利用LiOH和钴氧化物可制备锂离子电池。正极材料LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图16所示的装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为_____溶液(填化学式),阳极电极反应式为__________________。

(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钻氧化物的艺流程如图17:

Co(OH)3在酸溶并发生氧化还原反应时的离子方程式为______________________。在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体的质量为2.73g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L甲气体和1L乙气体恰好完全反应生成2L丙气体,若丙气体的分子式为XY2,则甲、乙的分子式为:( )
A.X2与Y2B.XY与Y2C.X2与XYD.YX2与Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花中含有绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法不正确的是( ) 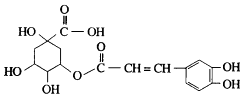
A.绿原酸的分子式为C16H8O9
B.1个绿原酸分子中含有4个手性碳原子
C.1mol绿原酸最多与4molNaOH反应
D.1mol绿原酸最多能与4molH2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
最低价态 | -2 | -4 | -3 | -1 | -3 | -1 |
试回答下列问题
(1) 以上10种元素的原子中,最易失去电子的是__________(填写元素符号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写出2种物质的分子式)_______________,______________
(3) ⑦元素在周期表中位于____________________________.
(4) 第三周期元素R的原子半径为1.02×10-10m,若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式:_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com