
如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
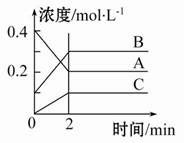
A.发生的反应可表示为:2A(g) 2B(g)+C(g)
2B(g)+C(g)
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.开始时,正逆反应同时开始
D.2 min时,A、B、C的浓度之比为2∶3∶1
 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
|
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 |
|
| B. | 由C(石墨)→C(金刚石)△H=+119kJ•mol﹣1可知,金刚石比石墨稳定 |
|
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则H2燃烧热的化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 |
|
| D. | 在稀溶液中,H+(aq)+OH﹣(aq)═(H2O)(l)△H=﹣57.3kJ•mol﹣1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关生活生产中的叙述合理的是( )
|
| A. | 硫酸工业中SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率 |
|
| B. | 打开啤酒瓶的瓶盖,有大量的气泡冒出来,该现象不能用勒夏特列原理解释 |
|
| C. | 氯碱工业中用离子交换膜电解槽电解时,往阴极室注入经过精制的饱和NaCl溶液,往阳极室注入稀氢氧化钠溶液(或去离子水) |
|
| D. | 工业上合成氨采用500℃左右的温度,最主要原因是该反应的催化剂在500℃左右时活性最好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
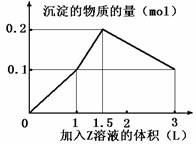
某混合溶液中, 含溶质X、Y各0.1 mol, 向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图, 则符合条件的X、Y、Z分别是( )
A.氯化铝、 氯化铁、 氢氧化钠
B.氯化铝、 氯化镁、 氢氧化钠
C.偏铝酸钠、 氯化钡、 硫酸
D.偏铝酸钠、 氢氧化钡、 硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中反应速率一定相同的是( )
A.表面积完全相同的锌片分别与同浓度、同体积的盐酸、硫酸在相同温度下反应
B.100 ℃时,向A、B两个容器中分别各加入0.2 mol HI发生分解反应
C.向分别盛有100 mL、200 mL水的两个烧杯中各加入少量表面积相同的钠
D.0.5 mol·L-1的NaHCO3(aq)分别与1 mol·L-1盐酸和1 mol·L-1的醋酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2)体系中发生反应的化学方程式是_____________________________________
___________________________________________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:____________
_____________________________________;
(4)该反应达到平衡时反应物X的转化率α等于______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H2(g)+F2(g)====2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是( )
A.2 L HF气体分解成1 L的H2和1 L的F2吸收270 kJ热量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.1个H2分子与1个F2分子反应生成2个HF分子放出270 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是( )
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?答:________________________________________________________________________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_________________________________________________。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com