
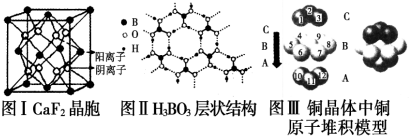
分析 (1)根据所属晶体类型判断熔点;H3BO3晶体受热熔化时,克服的微粒之间的相互作用为分子间作用力和氢键;
(2)金属铜采用面心立方最密堆积,空间利用率=74%,该合金中每一层均为密置层,Cu原子形成晶体后周围最紧邻的Cu原子数12;
(3)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子;硼酸分子中含有3个氧氢键极性键和3个B-O极性键;
(4)根据晶胞的结构来解答;根据体积的计算公式V=$\frac{m}{ρ}$进行计算.
解答 解:(1)CaF2为离子晶体,Cu为金属晶体,H3BO3为分子晶体,离子晶体的熔点高,金属晶体熔点大于分子晶体、小于离子晶体,即熔点由高到低的排列顺序为:CaF2>Cu>H3BO3;
H3BO3晶体中存在的作用力除共价键以外,分子和分子之间存在分子间作用力,有因氧的电负性大,分子之间存在氢键;
故答案为:H3BO3;分子间作用力、氢键;
(2)图Ⅲ所示的是由铜原子的密置层”)在三维堆积而成的面心立方最密堆积结构,其空间利用率为74%,每个铜原子与其紧邻的铜原子数为12;
故答案为:密置层;面心立方最密堆积;74%;12;
(3)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子;硼酸分子中含有3个氧氢键极性键和3个B-O极性键,所以B原子与极性键的个数比为1:6,
故答案为:O;1:6;
(4)由图Ⅰ所示的CaF2晶体中,若Ca2+处于面心,Ca2+最近且等距离的F-的个数为8个;该晶胞中F离子个数=8,钙离子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,则V=$\frac{m}{ρ}$进行=$\frac{\frac{40×4+19×8}{{N}_{A}}}{a}$cm3=$\frac{312}{aNA}$cm3,
故答案为:8;$\frac{312}{a{N}_{A}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、晶体的结构与性质、化学键等知识点,侧重考查学生分析计算能力,难点是晶胞计算,注意密度公式中各个字母含义,题目难度中等.


科目:高中化学 来源: 题型:推断题
 其合成路线如下:
其合成路线如下: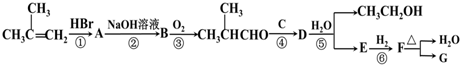
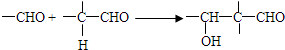
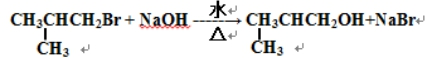 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内X、Y、Z浓度之比为1:2:2 | |
| D. | 混合气的平均摩尔质量不随时间变化时 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cl- | 0.9 |
| Ag+ | 0.5 | NO3- | 0.3 |
| Mg2+ | 0.3 |
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cu2+ | 0.2 |
| Ba2+ | 0.5 | NO3- | 1.5 |
| Mg2+ | 0.3 | Cl- | 0.6 |
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cl- | 0.2 |
| K+ | 0.5 | NO3- | 0.3 |
| Mg2+ | 0.3 | SO42- | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有含氢元素的化合物中都存在氢键,氢键比范德华力强 | |
| B. | H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 | |
| C. | 氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 | |
| D. | 分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 除去氯化钠溶液中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| B | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| C | 用0.10mol•L-1的盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸制取干燥、纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸的装运包装箱应贴上如图所示标志  | |
| B. | 少量金属金属钠保存在CCl4中 | |
| C. | 镁带着火应用干粉灭火器灭火,不能用泡沫灭火器灭火 | |
| D. | 用25ml酸式滴定管量取20.00ml0.01 mol/L的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化镁溶液中加氨水:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 碳酸钙溶于醋酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com