
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq)  I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
(3)为探究Fe2+ 对O3氧化I-反应的影响(反应体如左图),某研究小组测定两组实验中I3-浓度和体系pH,结果见右图和下表。
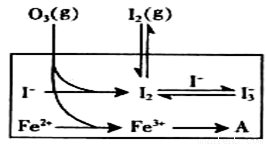

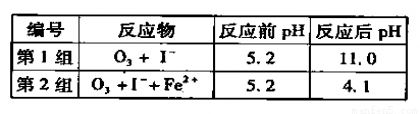
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2) 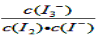
(3)①反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;
② Fe2+,因为Fe3+可以将I-直接氧化成I2,使溶液中c(I2)增大,促使I2(aq)+I-(aq) I3-(aq)的平衡右移,消耗的c(I-)增多,提高Ⅰ-的转化率。
I3-(aq)的平衡右移,消耗的c(I-)增多,提高Ⅰ-的转化率。
③ BC
(4)(计算过程略)5.5×10—4 mol/L·s
【解析】
试题分析:(1)①②③3步反应的方程式相加可得总方程式:O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O;根据盖斯定律可得:△H=△H1+△H2+△H3。
(2)根据平衡常数的定义可得I2(aq) + I-(aq)  I3-(aq),平衡常数表达式为
I3-(aq),平衡常数表达式为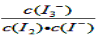 。
。
(3)①第1组实验中,O3氧化I?的离子方程式为:O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大。
②因为Fe3+的氧化性大于I2,Fe3+可以将I-直接氧化成I2发生反应:2Fe3++2I-==2Fe2++I2,所以A为Fe2+,因为该反应生成了I2,使溶液中c(I2)增大,进而使I2(aq)+I-(aq)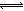 I3-(aq)的平衡右移,二者导致消耗的c(I-)增多,所以I?的转化率增大。
I3-(aq)的平衡右移,二者导致消耗的c(I-)增多,所以I?的转化率增大。
③对比表格中第1、2组实验前后pH可得,第1组pH增大,c(H+)减小,图中第1组实验所得I3-浓度曲线先略为增大后几乎不变,第2组pH减小,c(H+)增大,图中第2组实验所得I3-浓度曲线先显著增大后逐渐减小至无,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,A项错误;若c(I-)减小,则反应③HOI(aq)+I-(aq)+H+(aq)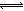 I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)
I2(aq)+H2O(l)的平衡左移,c(I2)也减小,导致I2(aq)+I-(aq)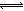 I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)减小,使 I2(aq)+I-(aq)
I3-(aq)的平衡左移,所以I3-浓度下降,B项正确;若I2(g)不断生成,导致I2(aq)减小,使 I2(aq)+I-(aq)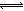 I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-氧化成I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)
I3-(aq)的平衡左移,则I3-浓度下降,C项正确;若c(Fe3+)增加,Fe3+将I-氧化成I2,则溶液中c(I2)增大,而海水中c(I-)略为减小或忽略不计,导致I2(aq)+I-(aq)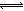 I3-(aq)的平衡右移,I3-浓度增大,D项错误。
I3-(aq)的平衡右移,I3-浓度增大,D项错误。
④读图14,3~18s内第2组实验中I3-浓度由 3.5×10-3mol/L增加到11.8×10-3mol/L,则生成I3-的平均反应速率v(I3-)=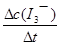 =
=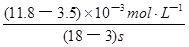 ≈5.5×10-4mol/(L?s),
≈5.5×10-4mol/(L?s),
考点:本题考查盖斯定律、平衡常数、化学平衡移动、反应现象和图像的分析、化学计算。


科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:选择题
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
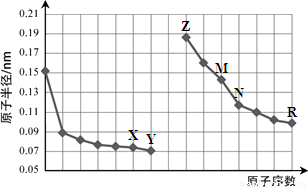
A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
B.简单离子的半径:X > Z > M
C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z单质不能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
下列叙述正确的是( )
A.碳酸氢钠溶液可用于区分乙酸、乙醇和苯
B.糖类、油脂、蛋白质都是高分子化合物,都可以在一定条件下发生水解反应
C.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:填空题
(16分)香豆素(结构如下图中Ⅰ所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。
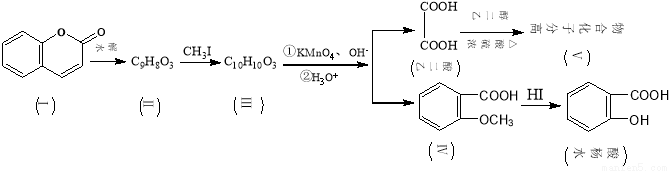 已知:CH3CH=CHCH2CH3
已知:CH3CH=CHCH2CH3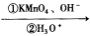 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)化合物Ⅱ分子中的含氧官能团的名称为 ,由乙二酸生成高分子化合物Ⅴ的反应类型为。
(2)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是(选填编号)
A.1molⅠ最多能和5mol H2发生加成反应B.可用FeCl3溶液来鉴别Ⅱ和Ⅲ
C.Ⅳ中核磁共振氢谱共有4种峰 D.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为
(4)Ⅲ的结构简式为 ,在上述转化过程中,设计反应步骤Ⅱ→Ⅲ的目的是 。
(5)化合物Ⅳ有多种同分异构体,请写出其中一种符合下列条件的同分异构体的结构简式: 。
①是苯的对位二取代物;②水解后生成的产物之一能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.煤经处理变为气体燃料的过程属于物理变化
B.淀粉、油脂和蛋白质都是高分子化合物
C.乙烯和乙醇均可使酸性KMnO4溶液褪色
D.乙酸乙酯和植物油均可水解生成乙醇
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确且有因果关系的是( )
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
C | SiO2与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
D | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
已知水在25℃和95℃时,其电离平衡曲线如图所示,下列说法错误的
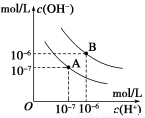
A.A曲线代表25℃时水的电离平衡曲线
B.当95℃时,pH=6的溶液呈中性
C.25℃时,将10mLpH=12的NaOH溶液与1mLpH=1的H2SO4 溶液混合,所得溶液的pH=7
D.95℃时,等体积等物质的量浓度的HA溶液和NaOH溶液混合后,当混合溶液的pH=6时,说明HA酸为弱酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
下列有关叙述不正确的是
A.MgO、Al2O3熔点高,可用于制作耐火材料
B.用浓氢氧化钠溶液可除去乙酸乙酯中混有的乙酸、乙醇杂质
C.除去NaCl溶液中的Na2CO3,应选择试剂为盐酸,而不是硝酸
D.油脂在碱性条件下易发生水解,可用于制作肥皂
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.电解饱和食盐水:2Cl-+ 2H2O 2OH-+ H2↑+ Cl2↑
2OH-+ H2↑+ Cl2↑
B.醋酸除去水垢中的CaCO3:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
C.漂白粉溶液在空气中失效:ClO-+ CO2 + H2O=HClO + HCO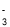
D.向NaHSO4溶液中滴加NaHCO3溶液:HSO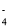 + HCO
+ HCO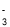 = H2O + SO
= H2O + SO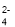 + CO2↑
+ CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com