
| 化学方程式 | 平衡常数K | 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 | Br2+H2?2HBr | 1.9×1019 |
| Cl2+H2?2HCl | 2.6×1033 | I2+H2?2HI | 8.7×102 |
| A. | X2与H2反应的反应速率依次减小 | B. | F2的转化率最大 | ||
| C. | X2与H2反应的剧烈程度逐渐减弱 | D. | 升高温度,平衡常数都增大 |
分析 A.反应速率与反应条件有关,题干中 无反应条件不能确定反应速率;
B.K值越大,说明反应的正向程度越大,即转化率越高;
C.反应的正向程度越小,说明生成物越不稳定,越易分解,反应程度越小,但不能判断与氢气反应的剧烈程度;
D.碘化氢不稳定易分解.
解答 解:A.反应速率受反应条件的影响,条件不定不能确定反应速率大小,故A错误;
B.K值越大,说明反应的正向程度越大,HF反应平衡常数最大,F2转化率最大,故B正确;
C.缺少反应条件,仅根据平衡常数,不能判断反应的剧烈程度,故C错误;
D.碘化氢不稳定易分解,升温碘化氢分解平衡常数减小,故D错误;
故选B.
点评 本题考查了影响影响化学反应速率、化学平衡、平衡常数的影响因素分析判断,注意反应速率、反应剧烈程度和反应条件有关,与平衡常数无直接关系,题目难度中等.


科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图: ,工业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3.
,工业合成该物质的化学方程式为N2+3H2$?_{催化剂}^{高温高压}$2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
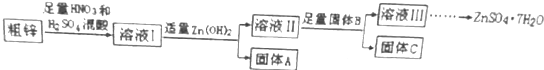
| 物质 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS |
| Ksp | 4.0×10-38 | 5.0×10-20 | 2.0×10-16 | 8.5×10-45 | 1.2×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+X2═2HX | B. | X2+H20═HX+HXO | ||
| C. | NaX+AgNO3═AgX↓+NaNO3 | D. | 2NaX+H2SO4(浓)═Na2SO4+2HX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融电解质中,O2-向正极定向移动 | |
| B. | 电池的总反应是:2C4H10+13O2═8CO2+10H2O | |
| C. | 通入空气的一极是正极,电极反应为:O2+4e-+2H2O═4OH- | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
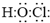 .二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O
.二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠(NaClO3)和另一种氯的含氯酸盐,同时生成水,该反应的离子方程式为2ClO2+2OH-═ClO3-+ClO2-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0;使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 图②表示25℃时,用0.01mol•L-1盐酸滴定一定体积的0.01mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 图③表示CH4(g)+H2O(g)?CO(g)+3H2(g)△H,反应CH4的转化率与温度、压强的关系,且P1>P2、△H>0 | |
| D. | 图④中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0;正、逆反应的平衡常数K随温度的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com