
| 物质 | X | Y | Z | W |
| 初始浓度/mol•L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
| A. | 增大压强反应的平衡常数不变,但X的转化率增大 | |
| B. | 该反应的化学方程式为:4X (g)+5Y (g)?4Z (g)+6W (g) | |
| C. | 反应达到平衡时,X的转化率为80% | |
| D. | 其它条件不变,若增大Y的起始浓度,X的转化率增大 |
分析 A、平衡常数只受温度影响,温度不变,平衡常数不变,增大压强平衡向气体体积减小的方向移动;
B、根据反应中反应物浓度减小,生成物浓度增加,各物质的浓度变化量之比等于反应中计量数之比判断;
C、由表中数据可知,平衡时X的浓度变化量为0.5mol/L-0.1mol/L=0.4mol/L,浓度变化量除以起始浓度再乘以100%等于该物质的量的转化率;
D、其它条件不变,增大一种反应物浓度,可以提高另一反应物的转化率.
解答 解:A、由表中数据可知,平衡时△c(X)=0.4mol/L,△c(Y)=0.6mol/L-0.1mol/L=0.5mol/L,△c(Z)=0.4mol/L,△c(W)=0.6mol/L,故X、Y、Z、W的化学计量数之比为0.4:0.5:0.4:0.6=4:5:4:6,故反应方程式为:4X(g)+5Y(g)?4Z(g)+6W(g),该反应为气体体积增大,增大压强,平衡逆向移动,X的转化率减小,故A错误;
B、由表中数据可知,平衡时△c(X)=0.4mol/L,△c(Y)=0.6mol/L-0.1mol/L=0.5mol/L,△c(Z)=0.4mol/L,△c(W)=0.6mol/L,故X、Y、Z、W的化学计量数之比为0.4:0.5:0.4:0.6=4:5:4:6,故反应方程式为:4X(g)+5Y(g)?4Z(g)+6W(g),故B正确;
C、由表中数据可知,平衡时X的浓度变化量为0.5mol/L-0.1mol/L=0.4mol/L,故X的转化率为$\frac{0.4mol/L}{0.5mol/L}$×100%=80%,故C正确;
D、根据反应4X(g)+5Y(g)?4Z(g)+6W(g)可知,其它条件不变,若增大Y的起始浓度,X的转化率增大,故D正确.
故选:A.
点评 本题考查化学平衡常数及影响因素、化学平衡移动的影响因素等,根据浓度变化量确定化学计量数书写方程式是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
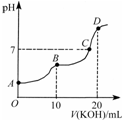
| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-) | |
| C. | C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
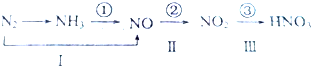
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:
常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ≥1.68L | B. | >1.68L | C. | ≤1.68L | D. | <1.68L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
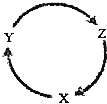 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Al(OH)3 | AlCl3 | Al2O3 |
| C | SiO2 | Na2SiO3 | H2SiO3 |
| D | NH3 | NH4Cl | NH4NO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
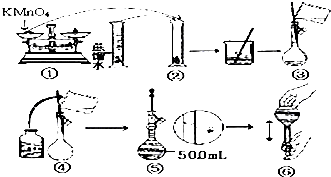 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com