
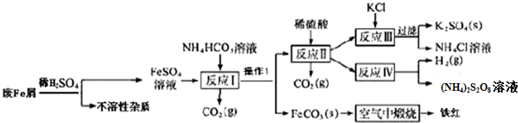
分析 废铁屑加入稀硫酸溶解过滤得到硫酸亚铁溶液和不溶性杂质,FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液,碳酸亚铁固体经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红.反应Ⅰ过滤后的溶液中含有硫酸铵、未反应的碳酸氢铵,加入硫酸反应后溶液中含有硫酸铵,反应Ⅲ加入KCl利用溶解度不同,得到硫酸钾与氯化铵,再进行过滤分离,反应Ⅳ在电解条件得到(NH4)2S2O8与氢气,
(1)FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液;
(2)分析可知操作①是分离固体和溶液的操作;反应Ⅱ溶液中阳离子为铵根离子,检验铵根离子失利用铵根离子和碱反应生成的氨气能使湿润的红色石蕊试纸变蓝设计检验;
(3)K2SO4易溶于水,但难溶于有机溶剂,要想使K2SO4析出需加入醇类溶剂,降低其溶解度;
(4)FeCO3的Ksp=2×10-11,反应I中Fe2+完全沉淀后溶液中亚铁离子浓度小于10-5mol/L,据此计算;
(5)空气中煅烧FeCO3生成铁红,碳酸亚铁和氧气反应生成氧化铁和二氧化碳;
(6)NH4Cl溶液因为水解原因呈酸性,氧化铁溶于酸生成铁离子和水.
解答 解:(1)FeSO4溶液中加入碳酸氢铵经反应Ⅰ可生成碳酸亚铁固体和硫酸铵溶液,同时生成二氧化碳气体,加入NH4HCO3的作用是除去过量的酸,还有一个作用是沉淀亚铁离子,故答案为:沉淀Fe2+;
(2)操作①是分离固体和溶液的操作;反应Ⅱ溶液中阳离子为铵根离子,检验铵根离子失利用铵根离子和碱反应生成的氨气能使湿润的红色石蕊试纸变蓝设计,取少许溶液于试管中,加入浓氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变蓝色证明生成了氨气,原溶液中含铵根离子,
故答案为:过滤;取少许溶液于试管中,加入浓氢氧化钠溶液加热,用湿润的红色石蕊试纸检验,试纸变蓝色证明生成了氨气,原溶液中含铵根离子;
(3)由题目看出在Ⅲ反应中生成的K2SO4为固体,而K2SO4在无机溶剂中溶解度是比较大的,要想使K2SO4析出只能降低其溶解度所以加入醇类溶剂目的降低K2SO4的溶解度,故答案为:降低K2SO4的溶解度,有利于K2SO4析出;
(4)反应I中Fe2+完全沉淀后溶液中亚铁离子浓度小于10-5mol/L,FeCO3的Ksp=c(Fe2+)c(CO32-)=2×10-11,得到溶液中c(CO32-)=2×10-6mol/L,
故答案为:2×10-6mol/L;
(5)空气中煅烧FeCO3生成铁红,反应的方程式为4FeCO3 +O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3 +4CO2,
故答案为:4FeCO3 +O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3 +4CO2;
(6)NH4Cl水解使溶液呈酸性,反应离子方程式为NH4++H2O?NH4•H2O+H+;铁锈(Fe2O3)在酸性条件下生成三价铁离子,反应离子方程式为Fe2O3+6H+=2Fe3++3H2O;
故答案为:NH4++H2O?NH4•H2O+H+、Fe2O3+6H+=2Fe3++3H2O.
点评 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
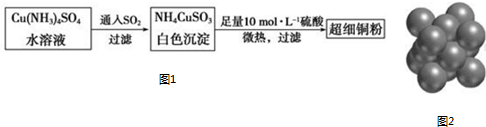
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com