
【题目】微量元素在生物体内含量很少,但必不可少,下列全属于微量元素的是
A. Fe Mn Zn Mg B. Zn Cu Mn Ca C. H O Na Mg D. Zn Cu B
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的电子式是_____,所含化学键类型为_____共价键(填“非极性”或“极性”)。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如图。

①Na-Fe3O4和HMCM-22在反应中的作用为______
②(X)的系统命名的名称为_____
③关于X与Y的说法正确的是___(填序号)。
a.最简式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.X与Y互称同系物
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出其与氯气反应生成一氯代烃的方程式_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应:2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
下列说法正确的是
A. 其他条件不变,容器乙达到平衡后,再充入体系中四种气体各1mol,平衡逆向移动
B. b=1.6
C. 平衡常数:K甲>K乙
D. 其他条件不变,向容器甲再充入1mol CO,平衡常数(K)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度容积相同的3个密闭容器中,按不同方式投入反应物并保持恒温恒容,测得反应达到平衡时的有关数据如下(已知:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJmol﹣1 )
2NH3(g)△H=﹣92.4kJmol﹣1 )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3molH2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(molL﹣1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | a1 | a2 | a3 |
下列说法正确的是( )
A. 2 c1>c3 B. a1+a3<1 C. 2 p2<p1 D. a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )

A. A→F,△H =一△H6
B. △H1 +△H2 + △H3 + △H4 + △H5 + △H6=0
C. C→F, △H= △H1+ △H2 + △H6
D. 若A→C为放热过程,则△H3 + △H4 + △H5 + △H6 >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
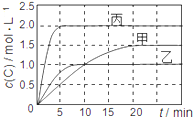
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度 | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是 ( )
A. 由图可知:T1<T2,且该反应为吸热反应
B. T1时该反应的平衡常数K=7.2
C. 前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙
D. 平衡时A的质量m:m乙<m甲<m丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理。某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性。
方案Ⅰ:甲同学设计如下装置制备氯化亚铁。
已知:实验室常用氯化钠固体与浓硫酸共热制备氯化氢;氯化亚铁能与水蒸气剧烈反应。
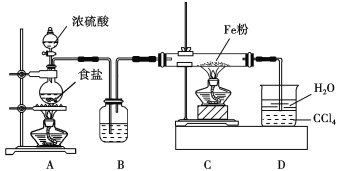
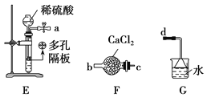
(1)写出A中反应的化学方程式: _______________。B中盛装的试剂为____________________,D装置中四氯化碳的作用是_____________。
(2)实验过程中,观察到D中现象是___________________________________________。
用物理方法检验氯化亚铁产品中是否混有铁粉:______________。
(3)上述方案有明显不足,请你提出改进上述方案的建议:______________________。方案Ⅱ:乙同学选择下列装置用氯化铁制备少量氯化亚铁(装置可以重复使用,氯化铁遇水剧烈水解)。查阅资料知,在加热条件下,氢气还原氯化铁生成氯化亚铁和氯化氢。
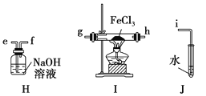
(4)气流从左至右,装置接口连接顺序是a______________________________________。
(5)设计简单实验证明氢气和氯化铁已发生反应:__________________________________。
(6)为了探究上述实验制备的氯化亚铁(Fe2+)具有还原性,设计如下方案:
a.取少量氯化亚铁样品溶于蒸馏水,滴加酸性高锰酸钾溶液,观察现象
b.取少量氯化亚铁样品溶于蒸馏水,滴加酸化的双氧水和KSCN溶液,观察现象
c.取少量氯化亚铁样品溶于蒸馏水,滴加铁氰化钾溶液,观察现象
d.取少量氯化亚铁样品溶于蒸馏水,先加KSCN溶液,后加氯水,观察现象
上述方案合理的是________(填代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com