
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
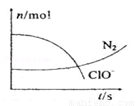
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
己知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)= 2Al2O3(s) ΔH1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:实验题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如图所示:
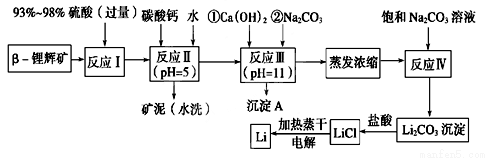
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是___________________。
(3)流程中两次使用碳酸钠溶液,请说明前后两次使用中浓度不同的原因:______________。
(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),你选择的理由是________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是:__________________________。
(6)下列关于金属锂及碱金属的说法正确的是___________(填序号)。
A.锂是碱金属,其熔点高于钠 B.根据对角线原则,氢氧化锂是强碱
C.金属锂的氧化物形式十分复杂 D.碱金属中密度最小的是锂,其次是钠
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
实验发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入5mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
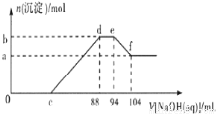
A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应NaOH溶液的体积为48 mL
C.b点与a点的差值为0.05 mol
D.样品中铝粉和铁粉的物质的量之比为5:3
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )
A.参加反应的H2SO4为0.2mol B.参加反应的NaOH约为0.27mol
C.加入铝粉的质量A=5.4 D.与硫酸反应的铝粉的质量7.2g
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
某物质的分子式为CxHyOz,取该物质ag在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若Na2O2固体的质量增加了bg,并且a<b,则x、y、z必须满足的关系是( )
A.x>z B.x=y=z C.x=z D.x<z
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:

(1)不考虑其它组的实验结果,单从甲组情况分析.如何用a(混合溶液的pH)来说明HA是强酸还是弱酸____________________。
(2)不考虑其它组的实验结果.单从乙组情况分析,C是否一定等于0.2_________(选填“是”或“否”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(3)丙组实验结果分析,HA是___________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是_______________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=__________mol/L。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:选择题
常温时,下列各组离子在指定溶液中能大量共存的是( )
A.pH=l的溶液中:Fe2+、NO3-、SO42-、Na+
B.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、CO32-
C.c(H+)/c(OH-)>1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2016-2017年吉林长春白城一中两校高二上期中化学卷(解析版) 题型:填空题
(1)下列化合物的分子中,所有原子都处于同一平面的有
A .乙烷 B.甲苯 C.氯苯 D.四氯乙烯
.乙烷 B.甲苯 C.氯苯 D.四氯乙烯
(2)下列除去杂质的方法正确的是
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液、干燥、蒸馏
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
(3)有下列各组物质:
A.O2和O3
B.12C和13C
C.CH3 —CH2—CH2—CH3和
—CH2—CH2—CH3和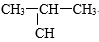
D.和
E.甲烷和庚烷
F.淀粉和纤维素
G.蔗糖和麦芽糖
H.聚乙烯和聚丙烯
① 组两物质互为同位素;
② 组两物质互为同素异形体;
③ 组两物质属于同系物;
④ 组两物质互为同分异构体;
⑤ 组中两物质是同一物质;
⑥ 组中两物质是混合物;
⑦ 聚丙烯的链节是 ;
⑧ 的名称是 。
的名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com