
分析 某短周期非金属元素固体单质A,呈淡黄色,则A为S;它与另一常见的短周期金属单质 B在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和一种臭鸡蛋味的气态氢化物 E,D 是某元素的最高价氧化物的水化物,既能溶于强酸,又能溶于强碱,属于两性氢氧化物,则B为Al,C为Al2S3,D为Al(OH)3,E为H2S;E 在足量空气中燃烧时,有刺激性气味的气体 G生成,G 在大气中能导致酸雨的形成,则G为SO2;E 被足量氢氧化钠溶液吸收得到无色溶液 F,则F为Na2S,溶液 F 在空气中长期放置发生反应,生成物之一为 H,H 与过氧化钠的结构和化学性质相似,则H为Na2S2,据此解答.
解答 解:某短周期非金属元素固体单质A,呈淡黄色,则A为S;它与另一常见的短周期金属单质 B在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和一种臭鸡蛋味的气态氢化物 E,D 是某元素的最高价氧化物的水化物,既能溶于强酸,又能溶于强碱,属于两性氢氧化物,则B为Al,C为Al2S3,D为Al(OH)3,E为H2S;E 在足量空气中燃烧时,有刺激性气味的气体 G生成,G 在大气中能导致酸雨的形成,则G为SO2;E 被足量氢氧化钠溶液吸收得到无色溶液 F,则F为Na2S,溶液 F 在空气中长期放置发生反应,生成物之一为 H,H 与过氧化钠的结构和化学性质相似,则H为Na2S2.
(1)组成单质 A的元素为硫元素,在周期表中的位置:第三周期第VIA族,故答案为:第三周期第VIA族;
(2)沉淀D为Al(OH)3,臭鸡蛋味气体 E为H2S,故答案为:Al(OH)3;H2S;
(3)G为SO2,与氯水反应的氧化产物为H2SO4,故答案为:H2SO4;
(4)溶液 F 在空气中长期放置生成 H 的化学方程式为:4Na2S+2H2O+O2=2Na2S2+4NaOH,故答案为:4Na2S+2H2O+O2=2Na2S2+4NaOH;
(5)H 的溶液与稀硫酸反应:Na2S2+H2SO4=Na2SO4+S↓+H2S↑,产生的现象为:溶液中产生淡黄色沉淀,同时有臭鸡蛋味气体放出,故答案为:溶液中产生淡黄色沉淀,同时有臭鸡蛋味气体放出.
点评 本题考查无机物推断,物质的颜色、反应现象等是推断突破口,需要学生熟练掌握元素化合物知识,难度不大,注意根据过氧化钠的性质理解Na2S2的性质.


科目:高中化学 来源: 题型:解答题
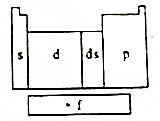 在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.
在研究原子核外电子排布与元素周期表的关系时,人们发现价电子排布相似的元素集中在一起,据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如图所示.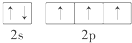 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化碳的化学式为C4N3 | |
| B. | 氮化碳的晶体类型为离子晶体 | |
| C. | 构成氮化碳晶体的微粒是碳原子和氮原子,且构成空间网状结构 | |
| D. | 氮化碳晶体中存在的微粒间的作用力有共价键和分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
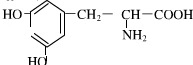 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 浓硫酸溅在皮肤上,使皮肤呈黄色是由于浓硫酸和蛋白质发生了颜色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com