
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<Iz2 | 氢化物沸点:FH<HCI<HBr<HI |
| B | 用电解熔融MgCI2可制得金属 | 用电解熔融NaCI也可以制取金属钠 |
| C | 将CO:通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | AI与S加热时直接化合生成AI2S3 | Fe与S加热时也能直接化合生Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HF分子间存在氢键,导致其沸点在卤化氢中最高;
B.Na和镁都为活泼金属,通过电解法可以获得金属单质;
C.二氧化硫溶于水溶液呈酸性,硝酸根离子在酸性条件下能够将二氧化硫氧化成硫酸,硫酸与硝酸钡反应生成硫酸钡沉淀;
D.铁与S单质加热反应生成是硫化亚铁.
解答 解:A.由于HF分子间存在情况,导致HF的沸点较大,正确的沸点高低为:HCl<HBr<HI<HF,故A错误;
B.金属Na、Mg的活泼性较强,工业上用电解熔融MgCl2可制得金属镁,用电解熔融NaCl也可以制取金属钠,故B正确;
C.将CO通入Ba(NO3)2溶液中,二者不发生反应,则无沉淀生成,但是将SO2通入Ba(NO3)2溶液中会生成硫酸钡沉淀,故C错误;
D.Al与S加热时直接化合生成Al2S3,由于硫单质的氧化性较弱,Fe与S加热时也能直接化合生成的是FeS,而不是Fe2S3,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及氢键、金属冶炼及元素化合物性质应用等知识,C为易错点,注意二氧化硫与硝酸钡能够生成硫酸钡沉淀,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2+、H+、NO3-、Cl- | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Mg2+、OH-、SO42- | D. | K+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2+O2═2H2O△H=-571.6 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
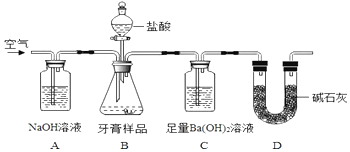 化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
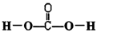 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都能溶于水并且都能和水反应,前者的溶解度大于后者 | |
| B. | 两者都能用于治疗胃酸过多疾病,前者的效果好于后者 | |
| C. | 足量的Na2CO3和NaHCO3分别与等物质的量的稀盐酸反应,前者产生CO2多 | |
| D. | 等体积等浓度的AlCl3溶液分别和足量的Na2CO3和NaHCO3反应,前者产生CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com