
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO4、Na2SO3、NaHSO3 | SO3、X、Na2SO4、NaHSO4 |
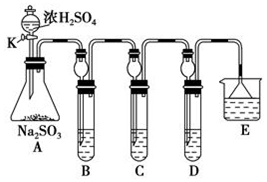
分析 (1)将相关的含硫物质依据硫元素化合价分组,第3组物质中硫元素的化合价都是+6价,判断X为+6价的酸为H2SO4 ;
(2)研究SO2的性质:A中硫酸与亚硫酸钠反应生成二氧化硫,B中二氧化硫与硫化氢发生氧化还原反应生成单质S;C中二氧化硫与KMnO4溶液发生氧化还原反应;D为尾气处理装置,二氧化硫与NaOH反应,E可防止二氧化硫排放在环境中,以此来解答.
①二氧化硫与硫化氢发生氧化还原反应生成单质S,二氧化硫中硫从+4降为0价,表现为氧化性;
②SO2被氧化时,S元素的化合价由+4价升高为+6,Mn元素的化合价是从+7价降低到了+2价,氧化还原反应中,化合价升高值=化合价降低值=转移电子数,根据电子守恒、原子守恒书写方程式;
③若装置F中有40mL 2.5mol•L-1NaOH溶液,反应后增重4.8g,吸收的为二氧化硫气体,依据反应方程式及二氧化硫氢氧化钠物质的量进行分析判断生成产物,然后写出反应的化学方程式即可.
解答 解:(1)将相关的含硫物质依据硫元素化合价分组,依据第3组物质中硫元素的化合价都是+,6价,按照氧化物、酸、正盐、酸式盐的顺序排列下来,判断X为+6价的酸为H2SO4,
故答案为:H2SO4;
(2)①A中硫酸与亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,B中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性,
故答案为:SO2+2H2S=3S↓+2H2O;
②在C中装KMnO4溶液,二氧化硫具有还原性,两者反应,Mn元素的化合价是从+7价降低到了+2价,降低了5,硫元素的化合价从+4价升高到了+6价,升高了2价,所以最小公倍数为10,Mn元素前边系数是2,SO2前边系数是5,根据原子守恒电荷守恒,化学反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4,离子方程式为:5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+,
故答案为:5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+;
③若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH═Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH═NaHSO3;装置D中有40mL 2.5mol•L-1 NaOH溶液中n(NaOH)=0.1mol,n(SO2)=$\frac{4g}{64g/mol}$=0.0625mol;所以生成产物为亚硫酸钠和亚硫酸氢钠;设生成亚硫酸钠xmol、亚硫酸氢钠ymol,2x+y=0.1mol,x+y=0.0625,解得:x=0.0375mol,y=0.025mol,即n(Na2SO3):n(NaHSO3)=3:2,所以反应的化学方程式为:5SO2+8NaOH=3Na2SO3+2NaHSO3+3H2O,
故答案为:5SO2+8NaOH=3Na2SO3+2NaHSO3+3H2O.
点评 本题考查物质制备实验及性质实验,主要考查了二氧化硫的化学性质及检验方法,题目难度中等,明确各装置的作用及发生的化学反应是解答本题的关键,注意掌握二氧化硫的性质及检验方法.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn2+的还原性弱于H2O2 | |
| B. | MnO4-是氧化剂,O2是氧化产物 | |
| C. | 生成lmol O2时,转移4 mol电子 | |
| D. | 离子方程式中按物质顺序的化学计量数是2、5、6、2、5、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- | B. | Na+ | C. | H+ | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢笔的笔头不易被氧化,抗腐蚀性能好 | |
| B. | 铱金笔的耐磨性能比钢笔好 | |
| C. | 金笔的笔头和笔尖都是用纯金制成的 | |
| D. | 金笔经久耐磨,是一种很理想的硬笔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
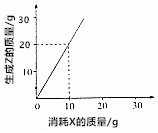
| A. | 有4g Z生成时,则消耗Y 3g | B. | X、Y、Z的摩尔质量之比为1:1:2 | ||
| C. | X、Y、Z的摩尔质量之比为2:3:2 | D. | X、Y、Z的摩尔质量之比为3:2:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com