
分析 A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大,则A为H元素;B、D的原子序数之差为8,二者只能同主族,B原子最外层电子数是其次外层电子数的3倍,最外层电子数不超过8,故B原子只能有2个电子层,最外层电子数为6,则B为O元素,D为S元素;E的原子序数大于硫,故E为Cl;C原子在同周期主族元素中原子半径最大,处于IA族,原子序数大于氧,故C为Na.
解答 解:A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大,则A为H元素;B、D的原子序数之差为8,二者只能同主族,B原子最外层电子数是其次外层电子数的3倍,最外层电子数不超过8,故B原子只能有2个电子层,最外层电子数为6,则B为O元素,D为S元素;E的原子序数大于硫,故E为Cl;C原子在同周期主族元素中原子半径最大,处于IA族,原子序数大于氧,故C为Na.
(1)B为O元素,在周期表中的位置为第二周期ⅥA族;A、E单质分别为氢气、氯气,二者反应的条件是:点燃或光照,
故答案为:第二周期ⅥA族;点燃或光照;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,
C单质与A的氧化物反应的化学方程式是:2 Na+2 H2O=2NaOH+H2↑,
故答案为:Na>S>O;2 Na+2 H2O=2NaOH+H2↑;
(3)设计实验证明氯的非金属性比硫的非金属性强:向H2S(或Na2S)溶液中滴加氯水,若溶液变浑浊,则证明Cl的非金属性比S的强,
故答案为:向H2S(或Na2S)溶液中滴加氯水,若溶液变浑浊,则证明Cl的非金属性比S的强;
(4)氢气、氧气能组成电池,电解质溶液为硫酸稀溶液,负极上氢气失去电子,酸性条件下生成氢离子,负极的电极反应式为:H2-2e-=2H+,
故答案为:H2-2e-=2H+.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表结构、元素周期律、核外电子排布,掌握金属性、非金属性强弱比较实验事实.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 漂白粉露置在空气中:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用少量氨水吸收二氧化硫:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 少量CO2通入苯酚钠溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

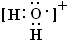 .该阳离子中存在的化学键有共价键.
.该阳离子中存在的化学键有共价键.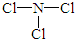 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000 mol•L-1NaOH溶液滴定20.00mL0.1000 mol•L-1CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B=A | |
| D. | 图4表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
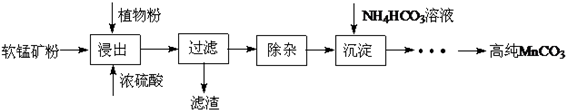
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯是无毒高分子化合物,可用作食品包装 | |
| B. | 在日常生活中,电化学腐蚀是造成钢铁腐蚀的主要原因 | |
| C. | 推广使用新能源,可以减少二氧化碳等温室气体的排放 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 | |
| B. | 等质量的O2与O3中,氧原子的个数比为3:2 | |
| C. | CaCl2及CaO2固体中阴、阳离子数之比均为2:1 | |
| D. | 10mL 0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| C. | 玛瑙的主要成分是二氧化硅,陶瓷的主要成分是硅酸盐 | |
| D. | 豆浆制豆腐、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
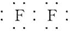 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com