
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是

A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
【答案】D
【解析】
A、电解池工作时,CO(NH2)2失去电子,a为阳极发生氧化反应;
B、阴极产生H2,则阴极反应式为:2H2O+2e-═2OH-+H2↑;
C、阳极的电极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,根据电极反应计算;
D、a极发生CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,a极区溶液pH降低。
A、电解池工作时,CO(NH2)2失去电子,a为阳极发生氧化反应,故A正确;
B、阴极水得电子产生H2,则阴极反应式为:2H2O+2e-═2OH-+H2↑,故B正确;
C、阳极的电极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,若电路中通过6mol电子,阳极产生N2的物质的量为n(N2)=6mol×1/6=1mol,故C正确;
D、a极发生CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,a极区溶液中氢离子浓度增大,溶液的pH降低,故D错误。
故选D。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
![]()
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是

A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液A可能含有Na+、NH4+、Mg2+、Fe3+、Ba2+、Clˉ、SO42-、Iˉ、CO32-、HCO3-离子中的若干种。取该溶液进行如下实验:(已知Ag2SO4微溶于水,可溶于硝酸):

下列说法正确的是
A.溶液A中一定没有Ba2+,可能存在SO42-
B.白色沉淀甲一定为Mg(OH)2
C.溶液A中一定存在NH4+、Clˉ,一定不存在Fe3+、Iˉ、CO32-
D.判断溶液A中是否存在Fe3+,需向溶液A中加入KSCN溶液观察溶液是否变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐。服用维生素C,有利于人体对铁元素的吸收。
(1)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作 用下转化成亚铁盐。此反应的离子方程式______。
(2)工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。
(3)“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
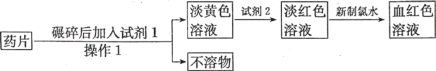
①操作1的名称是__________。
②试剂2为______溶液(填化学式)。
③加入新制氯水,溶液中发生反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“ ZEBRA”绿色电池是新型电动汽车的理想电源,结构如图所示:隔开两极的陶瓷管作钠离子导体。下列关于该电池的叙述错误的是

A. 放电时,Na+、Al3+均向负极移动
B. 放电时,Na元素被氧化
C. 充电时的阳极反应为:Ni+2C1--2e—=NiCl2
D. 该电池具有可快充、高比功率、放电持久等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )

A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电完成后,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
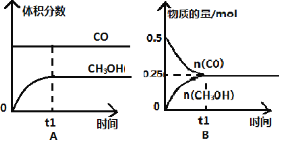


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列八种有机物:
现有下列八种有机物:①CH4,②CH3CH2OH,③ ,④癸烷,⑤CH3COOH,⑥
,④癸烷,⑤CH3COOH,⑥![]() ,⑦
,⑦![]() ,⑧丙烷
,⑧丙烷
根据上述物质,回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为___________________。
(2)与③互为同分异构体的是__________![]() 填序号
填序号![]() 。
。
(3)具有特殊气味,常作萃取剂的某有机物在FeBr3作催化剂的条件下可与液溴发生取代反应,该反应的化学方程式为________________。
(4)有机物②在加热条件下和CuO反应的化学方程式为______________________。
(5)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是__________![]() 填序号
填序号![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com