
下列处置、操作或现象的描述中正确的是
①漂白粉露置在空气中保存
②金属镁着火时,可用CO2灭火
③让一束光通过胶体,会出现一条光亮的“通路”
④有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑
A.①② B.①③ C.②④ D.③④
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2014-2015福建省福州市高一上学期期中化学试卷(解析版) 题型:选择题
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:由上述现象可推知a、b、c、d依次是
反应物 | a+b | c+d | a+d | a+c | b+d |
现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
A.HCl、BaCl2、AgNO3、Na2CO3
B.AgNO3、HCl、BaCl2、Na2CO3
C.AgNO3、HCl、Na2CO3、BaCl2
D.BaCl2、Na2CO3、 AgNO3、HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:选择题
第3周期元素形成的单质中,属于原子晶体的是
A.单晶硅 B.金刚石 C.金刚砂 D.二氧化碳
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.K+、OH-、CO32- B.Cu2+、H+、Cl-
C.K+、H+、Cl- D.CO32-、OH-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
对于溶液中某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO
B.加入NaOH固体,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+
C.先滴加氯水,再滴加KSCN溶液后显红色,则一定有Fe2+而没有Fe3+
D.滴加硝酸银,生成白色沉淀,再滴加稀盐酸,沉淀不溶解,则含有Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高一上学期期末考试化学试卷(解析版) 题型:选择题
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是
A.定容时俯视液面 B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:实验题
(14分)某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测溶液的体积(mL) | 0.100 0 mol·L-1NaOH的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期末考试化学试卷(解析版) 题型:选择题
在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g) 2HI (g)达到平衡的标志是
2HI (g)达到平衡的标志是
A.H2、I2、HI的分子数之比为1∶1∶2
B.混合气体的颜色不再发生变化
C.单位时间生成n mol H2,同时消耗成2n mol HI
D.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川九中高三上学期期中化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,0.3mol三氧化硫中含有氧原子数为0.9NA
B.aL甲烷和乙烷混合气体中的分子数为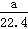 NA
NA
C.5.6 g铁与足量氯气或硫蒸气反应转移的电子数为0.3 NA
D.1L 1mol/L醋酸溶液中离子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com