
| X | Y | |
| Z | W | |
| T |
 (写电子式);
(写电子式);分析 短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,T为Se,然后结合元素及其单质、化合物的性质来解答.
解答 解:短周期元素,Z元素原子的核外电子总数是其最外层电子数的3倍,设最外层为x,则(2+8+x)=3x,解得x=5,则Z为P;然后由元素周期表中的位置可知,X为C,Y为N,W为S,
(1)上述元素的氢化物中,只有氨气的水溶液显碱性,氨气的化学式为NH3,其电子式为 ,
,
故答案为: ;
;
(2)X为C,其最外层4个电子,W为S,其最外层6个电子,XW2的电子式为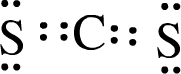 ,结构式为S=C=S,
,结构式为S=C=S,
故答案为:S=C=S;
(3)非金属性越强,氢化物越稳定,则稳定性为NH3>PH3,故答案为:NH3>PH3;
(4)FeCl2溶液滴加Y的最高价氧化物的水化物硝酸,该反应的离子方程式3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(5)T为Se,位于第四周期第VIA;最高正价为+6价,最低价为-2价,则T元素最高正价与最低负价的绝对值之差为4,故答案为:第四周期第VIA;4;
(6)含W、Y两元素的含氧酸正盐A,既于HCl反应,也与NaOH 反应,为亚硫酸对应的铵盐,则A的化学式为(NH4)2SO3,故答案为:(NH4)2SO3.
点评 本题考查位置、结构、性质的关系及应用,为高频考点,明确Z的原子结构关系推断元素是解答本题的关键,注意利用位置及电子数的关系来计算确定Z,并熟悉物质的性质来解答即可,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用SO2漂白纸浆和草帽辫 | |
| B. | SO2具有强还原性,浓硫酸具有强氧化性,故浓硫酸不能用于干燥SO2气体 | |
| C. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 | |
| D. | Na2SO3与H2O2的反应为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
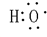 ;C22-(电子式)
;C22-(电子式) ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
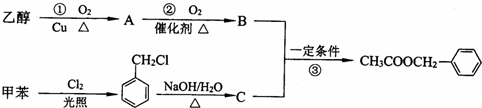
 .
. ..
.. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电塑料是应用于电子工业的一种新型有机高分子材料 | |
| B. | 复合材料一般是以一种材料作基体,另一种材料作为增强体 | |
| C. | 高分子分离膜应用于食品工业中,可用子浓缩天然果汁、乳制品加工、酿造业等 | |
| D. | 合成高分子材料制成的人工器官都会受到人体的排斥作用,难以达到生物相容的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com