
| ���� | �� | �� | �� | �� |
| A | 2mol | 1mol | 2mol | 1mol |
| B | 1mol | 1mol | 2mol | 2mol |
| A�� | A��ת���ʣ����������ң��� | B�� | A��ת���ʣ������ң������� | ||
| C�� | B��ת���ʣ������ף��ң��� | D�� | B��ת���ʣ��ף��ң������� |
���� ���൱�����ҵĻ�����������A�����ʵ��������Լ���B��ת���ʴ�������B��ת���ʣ���A��ת����ҪС������A��ת���ʣ�
���൱�����ҵĻ�����������B�����ʵ��������Զ���A��ת���ʴ�������A��ת���ʣ���B��ת����ҪС������B��ת���ʣ�
��������ȣ��൱��������ѹǿ��ƽ�����淴Ӧ�����ƶ�������ת���ʾ����ͣ�
���ͼ���ȣ��൱���ڼĻ�����������B�����ʵ��������Ա���A��ת���ʴ��ڼ���A��ת���ʣ���B��ת����ҪС�ڼ���B��ת���ʣ�
���Ͷ���ȣ��൱���ڶ��Ļ�����������A�����ʵ��������Ա���B��ת���ʴ��ڶ���B��ת���ʣ���A��ת����ҪС�ڶ���A��ת���ʣ�
��� �⣺����ʼʱ������������У�
2A��g��+B��g��?3C��g��+2D��g��
�� 2 mol 1 mol
�� 1 mol 1 mol
�� 2 mol 2 mol
�� 1 mol 2 mol
AԽ��BԽ�࣬A��ת����Խ�ߣ���Aת������ߵ�Ϊ������͵�Ϊ�ף��������Ƚϣ����൱�����ҵĻ������ٷֱ�����1 mol A��1 mol B�����Ǻ���Ϊ��ѹ��ƽ�������ƶ�ʹA��ת���ʼ�С����A��ת���ʴ�СΪ�������ң������ף�ͬ����B��ת���ʴ�СΪ���ף��ң���������
��ѡBD��
���� ���⿼�黯ѧƽ�⼰��Ӱ�죬��Ŀ�Ѷ��еȣ�ע��Ա����������ڸ����ʵ����ʵ�����ϵ�����Ӱ��ƽ���ƶ������ؽ������������ѧ���ķ������������Ӧ��������


 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
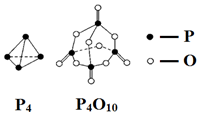
| A�� | -��6a-12b-4c+5d��kJ•mol-1 | B�� | -��-6a+12b+4c-5d��kJ•mol-1 | ||
| C�� | -��-4a+6b+4c-5d��kJ•mol-1 | D�� | -��4a-6b-4c+5d��kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ʳ��ˮ | C�� | ��������Һ | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
| n��X�� | n��Y�� | n��M�� | |||
| �� | 700 | 0.40 | 0.10 | 0.090 | |
| �� | 800 | 0.10 | 0.40 | 0.080 | |
| �� | 800 | 0.20 | 0.30 | a | |
| �� | 900 | 0.10 | 0.15 | b | |
| A�� | ʵ����У���5 minʱ���n��M��=0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v��N��=1.0��10-2 mol•L-1•min-1 | |
| B�� | ʵ����У��÷�Ӧ��ƽ�ⳣ��K=2.0 | |
| C�� | ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ60% | |
| D�� | ʵ����У��ﵽƽ��ʱ��b��0.060 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��Ӧʱ��/min | n��SO2��/mol | n��O2��/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A�� | ��Ӧ��ǰ 5min ��ƽ������Ϊ v ��SO2��=0.08mol•L-1•min-1 | |
| B�� | �����¶Ȳ��䣬��ƽ�����������ٳ��� 1molSO2�� 0.5molO2ʱ��v ��������v ���棩 | |
| C�� | ���¶ȣ���Ӧ��ƽ�ⳣ��Ϊ 11.25L•mol-1 | |
| D�� | ��ͬ�¶��£���ʼʱ�������г��� 1.5mol SO3����ƽ��ʱ SO3��ת����Ϊ 40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�ⷴӦ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�
����ԭCO2�ǽ������ЧӦ����Դ�������Ҫ�ֶ�֮һ���о���������Cu/ZnO���������£�CO2��H2�ɷ�������ƽ�ⷴӦ���ֱ�����CH3OH��CO����Ӧ���Ȼ�ѧ����ʽ���£�| T��K�� | ���� | CO2ת���ʣ�%�� | �״�ѡ���ԣ�%�� |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | X | Y | Z | Q |
| ʱ�� | ||||
| ��ʼ/mol | 0.7 | 1 | ||
| 2minĩ/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3minĩ/mol | 0.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ԭ��ص����������Է�Ӧ��2Fe3++Cu=2Fe2++Cu2+���һ��ԭ��أ�
�������ԭ��ص����������Է�Ӧ��2Fe3++Cu=2Fe2++Cu2+���һ��ԭ��أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
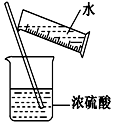 ���л�ѧʵ�����ע�ⰲȫ������˵������ȷ������ǣ�������
���л�ѧʵ�����ע�ⰲȫ������˵������ȷ������ǣ�������| A�� | �٢ڢۢ� | B�� | �٢ڢ� | C�� | �٢ڢ� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com