
【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:
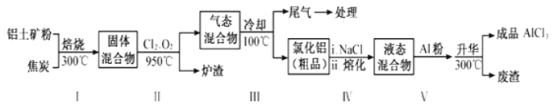
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。
【答案】 ![]()
![]() SiCl4(g)+2H2(g)
SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) △H=+0.01akJ·mol-1 Al3++3H2O
Si(s)+4HCl(g) △H=+0.01akJ·mol-1 Al3++3H2O![]() Al(OH)3+3H+ AlCl3是共价化合物 可以防止后续步骤生成的AlCl3水解,同时由于增大反应物的接触面积,使反应速率加快 铁 KCl、KClO、KClO3 4KClO3
Al(OH)3+3H+ AlCl3是共价化合物 可以防止后续步骤生成的AlCl3水解,同时由于增大反应物的接触面积,使反应速率加快 铁 KCl、KClO、KClO3 4KClO3![]() KCl+3KClO4 除去FeCl3,提高AlCl3纯度
KCl+3KClO4 除去FeCl3,提高AlCl3纯度
【解析】(1) 第三周期的元素,原子最外层电子数是核外电子总数![]() 的元素是P,其原子结构示意图为
的元素是P,其原子结构示意图为![]() ;非金属性最强的元素是Cl,所以还原性最弱的简单阴离子
;非金属性最强的元素是Cl,所以还原性最弱的简单阴离子![]() 。
。
(2) 生成2.8kg纯硅的物质的量为100mol,需要吸收akJ热量,所以生成1mol Si要吸收0.01akJ热量,该反应的热化学方程式为SiCl4(g)+2H2(g) ![]() Si(s)+4HCl(g) △H=+0.01akJ·mol-1 。
Si(s)+4HCl(g) △H=+0.01akJ·mol-1 。
(3)氯化铝的水溶液可用于净水,其原理是铝离子水解生成氢氧化铝胶体将水中悬浮颗粒吸附转化为沉淀沉降下去,使水变得澄清,用离子方程式表示为Al3++3H2O![]() Al(OH)3+3H+。
Al(OH)3+3H+。
①工业制铝时,电解Al2O3而不电解AlCl3的理由是AlCl3是共价化合物 ,在熔化状态下不导电,所以无法电解。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是可以防止后续步骤生成的AlCl3水解,同时由于增大反应物的接触面积,使反应速率加快。
③固体混合物中含有过量的焦炭,步骤Ⅱ中若不通入氯气和氧气,则在高温下焦炭可以把氧化铁还原为铁,所以反应生成相对原子质量比硅大的单质是铁。通入氧气可以把碳转化为二氧化碳,通入氯气可以把氧化铁和氧化铝转化为易升华的氯化铁和氯化铝。
④尾气含二氧化碳、过量的氯气等,经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有氯气与氢氧化钾反应生成的KCl、KClO、KClO3等3种;其中氯酸钾可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,不生成氧气,化合价发生变化的只能氯元素一种。其中一种无氧酸盐只能是氯化钾,氯元素的化合价从+5降到-1,另一种盐中氯元素的化合价只能从+5升高到+7,由阴阳离子个数比为1:1,推出另一种盐为高氯酸钾。该反应的化学方程式为4KClO3![]() KCl+3KClO4 。
KCl+3KClO4 。
⑤由表中数据可知,在300℃氯化铝和氯化铁都可以升华,所以步骤V中加入铝粉的目的是把氯化铁还原为沸点较高的氯化亚铁或铁以除去FeCl3,提高AlCl3纯度。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液制斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。

己知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升卨到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,
请写出发生堵塞时瓶b中的现象:①_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②_______________________________________________;安全瓶b还可以起到的作用是③__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(6)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则 此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学为探究原电池原理,设计如图所示装置,将锌、铜通过导线相连,置于稀硫酸中。
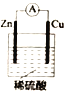
(1)锌片上的电极反应式为__________________。
(2)铜片上的现象是__________________。
(3)若反应过程中有0.2 mol电子发生转移,则生成的气体在标准状况下的体积为______________。
(4)该小组同学将稀硫酸分别换成下列试剂,电流计仍会偏转的是_________(填序号)。
A.无水乙醇 B.醋酸溶液 C.CuSO4溶液 D.苯
(5)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以通过原电池来实现。下列反应可以设计成原电池的是________(填字母代号)。
A. NaOH+HCl= NaCl+H2O B. 2H2+O2=2H2O
C. Fe+2FeCl3=3FeCl2 D. 2H2O=2H2↑+2O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下元素周期表,己知X元素的气态氢化物水溶液呈碱性,空格中均有对应的元素填充。以下说法正确的是
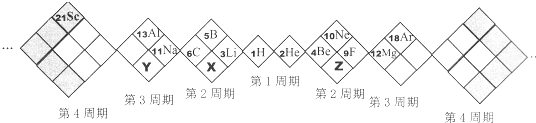
A. X、Y、Z元素分别为N、P、O
B. 白格中都是主族元素,灰格中都是副族元素
C. 原子半径:Z>X>Y
D. X、Y、Z的气态氢化物中最稳定的是:X的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和相同体积,相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系式为
A. V3>V2>V1 B. V3=V2>V1
C. V1=V2>V3 D. V3>V2=V1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。 下列物品中用到硅单质的是( )
A. 陶瓷餐具 B. 石英钟表 C. 计算机芯片 D. 光导纤维
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com