
��ҵ���Ի�����Ϊԭ���������ᣬ������Ҫ��һ���Ǵ�����(�����б��ֺ��º�������)��2SO2(g)��O2(g)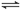 2SO3(g) ��H����196.6 kJ��mol��1
2SO3(g) ��H����196.6 kJ��mol��1
(1)������Ϊ��߷�Ӧ���ʺ�SO2��ת���ʣ����д�ʩ������ ��
A����װ���г���O2 B�������¶�
C����װ���г���N2 D����װ���г��������SO2
(2)���º�ѹ��ͨ��3mol SO2 ��2mol O2 �����������ƽ��ʱ�������������Ϊ��ʼʱ��90%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ 5mol SO2(g)��3.5 mol O2(g)��1mol SO3(g)������˵����ȷ����
 A����һ��ƽ��ʱ��Ӧ�ų�������Ϊ294.9kJ
A����һ��ƽ��ʱ��Ӧ�ų�������Ϊ294.9kJ
B������ƽ��SO2��ת�������
C������ƽ��ʱ��O2����������
D���ڶ���ƽ��ʱSO3�������������2/9
(3)500 ��ʱ��10 mol SO2��5.0 mol O2�������Ϊ1�̵ĺ����ܱ������У�SO2ת��ΪSO3��ƽ��ת����Ϊ0.95����500��ʱ��ƽ�ⳣ��K= ��
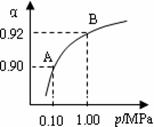
(4)550 �棬A��B��ʾ��ͬѹǿ�µ�ƽ��ת����(��ͼ)��
ͨ����ҵ�����в��ó�ѹ��ԭ���� ��
���Ƚϲ�ͬѹǿ�µ�ƽ�ⳣ����K(0.10 MPa) K(1.0 MPa)��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������(K2FeO4)��һ�����͡���Ч�����ˮ������������ˮ�����ӷ�Ӧ�ǣ�
4FeO42��+10H2O=4Fe(OH)3(����)+3O2��+8OH��
��ҵ�����Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���һ������KOH�Ϳ��Ƶø�����ء��Ʊ��������Ƶ����ַ�������Ҫ��Ӧԭ�����£�
ʪ���Ʊ�����2Fe(OH)3+3ClO��+4OH��=2FeO42��+3Cl��+5H2O��
�ɷ��Ʊ�����2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2����
�����й�˵���д�����ǣ�������
A�����������ˮ��Ӧʱ��ˮ����������Ӧ
B���ɷ���ÿ����1mol Na2FeO4��ת��4mol����
C��ʪ����ÿ����1mol Na2FeO4��ת��3mol����
D��K2FeO4����ˮʱ��������ɱ�������ܳ�ȥH2S��NH3�ȣ���ʹ�������ʳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)�ڱ�״���£�a.6.72 L CH4���塡b��3.01��1023��HCl������ӡ�c��13.6g H2S���塡d��0.2mol NH3�����ж�����������Ĺ�ϵ�Ӵ�С��������(��������ű�ʾ)��
��������������ʵ���___________________________________��
�ڱ�״��������������ܶ�_____________________________��
���������������_______________________________________��
(2)�����ӵ�������������һ��ʵ�飺һ��յ��ܱ�������Mg���ڱ�״���£�ʢ������ͬ���ʵ�����ϵ�NO��H2�Ļ���������Ϊ(M��Q)g���ѻ�������ž����ٳ���SO2���壬Ϊʹ��ƽƽ�⣬Ӧ��������ƽ��________�������Ϸ���________g���롣
(3)��10g����CuSO4��x(NH4)2SO4��yH2O�ӵ�������NaOH��Һ�м��ȣ����ɵİ�����100 mL 0.5mol/L����ȫ�����գ������������2mol/L NaOH��Һ�кͣ���ȥNaOH��Һ25 mL����֪������SO����������Ϊ48%����x��________��y��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���º��ݵ������ܱ�������N2(g)+3H2(g)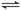 2NH3(g) ��H��-92.4 kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±�������������ȷ����
2NH3(g) ��H��-92.4 kJ/mol��ʵ������ʼ��ƽ��ʱ���й��������±�������������ȷ����
| ���� ��� | ��ʼʱ���������ʵ���/mol | ƽ��ʱ��Ӧ�е������仯 | ||
| N2 | H2 | NH3 | ||
| �� | 1 | 3 | 0 | �ų�����a kJ |
| �� | 2 | 3 | 0 | �ų�����b kJ |
| �� | 2 | 6 | 0 | �ų�����c kJ |
A���ų�����a<b<92.4 B�����������ڷ�Ӧ��ƽ�ⳣ����>��>��
C��N2��ת���ʢ�<�� D����ƽ��ʱ���������������>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ȩ����ľ����ԭ�Ϻϳɣ��ϳ�·������ͼ��ʾ�����ȩ�ĺϳ�·�ߡ�����˵����ȷ����
A�������Ϸ�Ӧ1��2��ԭ��������100%
B��������2��һ�������¿ɷ����Ӿ۷�Ӧ
C�������Ƶõ����ȩ���Ƿ���л�����3�������Ȼ�����Һ
D�������ʵ�����������������NaOH��Һ��Ӧ������NaOH���ʵ�����Ϊ1324
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����( )
A. �����ʵ��������������ӣ�OH�������(��CH3)�������������
B. ����Cu��ϡ������ɵ�ԭ��أ�����������������5.6 gʱ������H22.24L
C��16 g��������к��й��ۼ���Ŀ��Ϊ4NA
D��2.8 g��ϩ���ϩ�Ļ�����к�̼ԭ�ӵ���ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ����( )
����ˮ���𱽡��Ҵ����屽�� ���ñ���NaCl��Һ��ȥ�屽������Br2
�������Ը�����ؼ������ᡢ��ϩ���Ҵ������õ�ȼ�ķ���������顢��ϩ
������ˮ�ɼ��𱽡���ϩ���Ҵ������Ȼ�̼����Һ��
A���٢ڢ� B���ڢ� C���ڢۢ� D���٢ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͳ������ˮ����������Ư�۵�ǿ������������������л��ȶ�������һ����Σ����һ�����͵������������������Σ���Na2FeO4��K2FeO4������Ч��ɱ��ˮ�е�ϸ���Ͳ�����ͬʱ�������ˮ�о����仯���ܳ�ȥˮ�е�ϸ����������ϱ仯�������������漰�ı仯�У� ��
A . ���� B. ˮ�� C. �û���Ӧ D. ������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ƕ�Ԫ��ǿ�ᣬ����������Һ�����ԡ������£���10 mL 0.01 mol��L NaHC2O4��Һ�еμ�0.01 mol��L NaOH��Һ������NaOH��Һ��������ӣ���Һ������Ũ�ȹ�ϵ��ȷ����
A��V��NaOH��= 0ʱ��c��H+��= 1 �� 10��2 mol��L
B��V��NaOH��< 10 mLʱ�������ܴ���c��Na����= 2 c��C2O ��+ c��HC2O
��+ c��HC2O ��
��
C��V��NaOH��= 10 mLʱ��c��H+��= 1 �� 10��7mol��L
D��V��NaOH��> 10 mLʱ��c��Na����> c��C2O ��>c��HC2O
��>c��HC2O ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com