
| A. | CCl4 | B. | KI | C. | KCl | D. | Cl2 |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 葡萄糖用于医疗输液是因为它属于强电解质 | |
| C. | Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
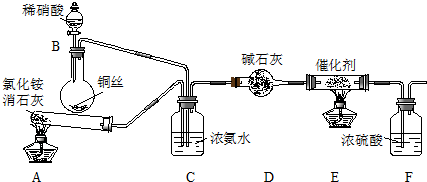
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(碳酸氢钠):加热,直到质量不再减少为止 | |
| B. | 溴苯(溴):加入氢氧化钠溶液洗涤,分液 | |
| C. | 乙醇(乙醛):加入新制氢氧化铜煮沸,过滤 | |
| D. | 乙酸丁酯(乙酸):加入碳酸钠溶液洗涤,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com