
在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)图中表示NO2的变化的曲线是____________。
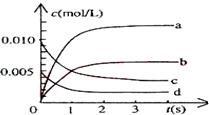
(2)能说明该反应已经达到平衡状态的是___________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v(NO)逆=2v(O2)正 d.容器内的密度保持不变
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是
__________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
科目:高中化学 来源: 题型:阅读理解
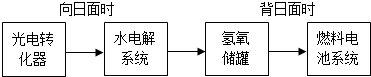
| 有关物质的物质的量/mol | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为
2C(g),在10秒内反应物A的浓度由1mol/L降到0.6mol/L,则用C浓度的变化表示的该反应在这段时间内的平均反应速率为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| [O2][H2]2 |
| [H2O]2 |
| [O2][H2]2 |
| [H2O]2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
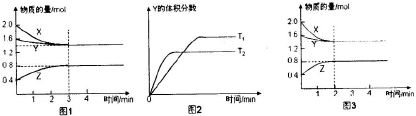
| A、反应进行的前3min内,用X表示的反应速率V(X)=0.1mol/(L?min) | B、平衡时容器内的压强为反应前的0.8倍 | C、保持其他条件不变,升高温度,反应的化学平衡常数K减小 | D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com