
����Ŀ����������Ũ�Ⱦ�Ϊ0.1molL��1��������Һ�� ��Na2CO3��NaHCO3��HCl ��NH3H2O
��1�����˳���Һ�������۵ġ������ԭ�����������ӷ���ʽ���ͣ�
��2����������Һ��ˮ�ĵ���̶��ɴ�С��˳���ǣ��������д��
��3������м��������Ȼ�粒��壬��ʱ ![]() ��ֵ���������С�����䡱����
��ֵ���������С�����䡱����
��4���������Ϣۺܵ͢���Һ����ʱ��Һ��[NH4+]+[NH3H2O]=molL��1������ֵ������ʱ��Һ������Ũ�ȵĴ�С˳���ǣ��������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�۵�����ܵ����������ڡ�С�ڡ����ڡ���
��5����10mL��Һ�ۼ�ˮϡ����100mL�����ʱ��Һ����ˮ�������c�� H+��= molL��1 ��
���𰸡�
��1��CO32��+H2O?HCO3��+OH��
��2���٢ڢܢ�
��3����С
��4��0.05��[Cl��]��[NH4+]��[H+]��[OH��]�� ��
��5��10��12
���������⣺��1��̼������Һˮ���Լ��ԣ����ӷ���ʽΪ��CO32��+H2OHCO3��+OH����
���Դ��ǣ�CO32��+H2OHCO3��+OH������2����Na2CO3 ��NaHCO3 ����Һ��������ˮ��ٽ�˭�ĵ��룬ˮ�ĵ���̶�����̼�������ˮ��̶ȴ���̼��������ӣ���ˮ�ĵ���̶Ȣ٣��ڣ���HCl ��NH3H2O����ͼ����ˮ�ĵ��룬һˮ�ϰ�Ϊ�����ˮ���Ƴ���С��ˮ����̶Ȣܣ��ۣ���������Һ��ˮ�ĵ���̶��ɴ�С��˳���Ǣ٢ڢܢۣ�
���Դ��ǣ��٢ڢܢۣ���3��һˮ�ϰ���Һ�д��ڵ���ƽ�⣬�����Ȼ�粒����ܽ��笠�����Ũ������ƽ��������У����������Ӽ�С��һˮ�ϰ�����ֵ��С��
���Դ��ǣ���С����4���������Ϣ�HCl ��NH3H2O�������Ȼ����Һ����Һ�д��������غ㣬��Ԫ���غ㣬��ʱ��Һ��[NH4+]+[NH3H2O]=0.05mol/L����Һ��笠�����ˮ����Һ�������ж���Һ������Ũ�ȴ�СΪ��[Cl��]��[NH4+]��[H+]��[OH��]�������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ���Ҫһˮ�ϰ��࣬һˮ�ϰ���Һ����Դ�����ǰ�۵����С�ڢܵ������
���Դ��ǣ�0.05��[Cl��]��[NH4+]��[H+]��[OH��]��С�ڣ���5��ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ���� ![]() ��Ϊ0.01mol/L����Kw=c��OH����c��H+����֪��c��OH����=10��12 molL��1�����ʱ��Һ����ˮ�������c��H+��=10��12 molL��1��
��Ϊ0.01mol/L����Kw=c��OH����c��H+����֪��c��OH����=10��12 molL��1�����ʱ��Һ����ˮ�������c��H+��=10��12 molL��1��
���Դ��ǣ�10��12��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Ĺ�ҵ��ˮ�к��д����������������϶��Cu2+�ͽ��ٵ�Na+�Լ�������ɳ��Ϊ�˼�����Ⱦ�����Ϊ���������ƻ��Ӹ÷�ˮ�л����̷��ͽ���ͭ���������ͼ����ͼ���ʵ�鷽����

��1������1������___________������IJ���������_____________________
��2����֪�Լ�1ΪFe���Լ�2Ϊϡ���ᣬ������2�������ʵĻ�ѧʽΪ__________
��3���ڳ�����Һ�м����Լ�1������ѧ��Ӧ����д���÷�Ӧ�����ӷ���ʽ____________��
��4������1�м����Լ�2������ѧ��Ӧ����д���÷�Ӧ�����ӷ���ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��µĺ����ܱ������У����淴Ӧ2NO2��g��![]() 2NO��g��+ O2��g���ﵽƽ��״̬�ı�־��
2NO��g��+ O2��g���ﵽƽ��״̬�ı�־��
��2V��O2��=V��NO2��
�ڵ�λʱ��������n molO2��ͬʱ����2n molNO2
��NO2��NO��O2��Ũ��֮��Ϊ2��2��1
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ƽ����Է����������ٸı�
A���ڢܢ� B���٢ܢ� C���ڢܢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�ӵ����չ�������״�Ķ����������ģ���Ҫԭ����(���� )
A. ԭ���е��ӵ������ߵ� B. ���������Ӱ��
C. ԭ�ӹ�������������ӻ��� D. �����豸�Ĺ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ã� 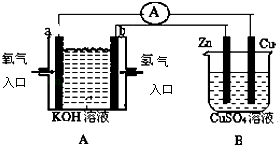
��1��װ��A��bΪ�����缫��ӦʽΪ��
��2��Bװ����CuΪ�����缫��ӦʽΪ��
��3����ͭƬ�������仯Ϊ12.8gʱ��a�������ĵ�O2�ڱ�״���µ����Ϊ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ժ������ʵ��о����������ż�Ϊ��Ҫ�����壮
��1��N2��O2��H2�֮����Է������Ϸ�Ӧ����֪��Ӧ���Ȼ�ѧ����ʽ���£� N2��g��+O2��g��=2NO��g����H=+180kJmol��1��
2H2��g��+O2��g��=2H2O��g����H=��483kJmol��1��
N2��g��+3H2��g��=2NH3��g����H=��93kJmol��1 ��
�Ĵ�������Ӧ���Ȼ�ѧ����ʽΪ ��
��2������β��������һ����Ӧԭ��Ϊ��2NO��g��+2CO��g��N2��g��+2CO2��g����H��0�� һ���¶��£���2.8mol NO��2.4mol COͨ��̶��ݻ�Ϊ2L���ܱ������У���Ӧ�����в������ʵ����ʵ����仯��ͼ1��ʾ��
��NO��ƽ��ת����Ϊ �� 0��20minƽ����Ӧ����v��NO��Ϊmol/��Lmin�������¶��µĻ�ѧƽ�ⳣ����ֵ�� �� 25minʱ�������ַ�Ӧ�¶Ȳ��䣬���������г���CO��N2��0.8mol����ѧƽ�⽫ �ƶ�������������ҡ���������
�����п�˵���÷�Ӧ�Ѿ��ﵽƽ����� ��
a�� v���ɣ�CO2��=v���ģ�CO��
b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı�
d����λʱ��������2n mol CO2��ͬʱ����n mol N��N
e��NO��CO��N2��CO2��Ũ�����
�۷�Ӧ�ﵽƽ��ı�ijһ����������ͼ2���ߢ�������ȷ���� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����շ�ɢ�����ӵĴ�С���ѷ�ɢϵ��Ϊ��_____������_____������_____����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�У�ֻ�м�����������ƽ�������ߵö�ķ�Ӧ����ӷ� ����ײʱ�ſ��ܷ�����ѧ��Ӧ����Щ���ӱ���Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ������л�ܣ��䵥λͨ���� kJ/mol ��ʾ��������۲���ͼ��Ȼ�� �ش����⡣

��1��ͼ����ʾ��Ӧ��_____(����ȡ����ȡ�)��Ӧ��
��2����֪�� 1mol H��H ����1mol I��I��1mol H��I ���ֱ���Ҫ���յ�����Ϊ 436kJ��151kJ��299kJ������ 1mol ������ 1mol �ⷴӦ���� HI ��_____(��ų������� �ա�)______kJ ���������ڻ�ѧ��Ӧ�����У��ǽ�_____ת��Ϊ_________��
��3�����з�Ӧ�У����ڷ��ȷ�Ӧ����_____���������ȷ�Ӧ����_____��
������ȼ�� ��ըҩ��ը ������кͷ�Ӧ �ܶ�����̼ͨ�����ȵ�̼
��ʳ�������������� ��Ba(OH)2��8H2O �� NH4Cl ��Ӧ ��������ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ���ں��ա�ұ��������ҵ������������һ�����������������̼���̿�(��Ҫ����FeS2��FeCO3��SiO2��CuO������)�Ʊ������̵Ĺ�����������:
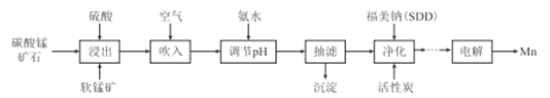
��֪:��.�����ƵĻ�ѧʽΪ(CH3)2CNS2Na,���ø����ƶ�MnSO4��Һ���ؽ������о���ȥ��Ч������:
��.���ֽ��������γ��������������pH���±���ʾ:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(��ʼ����) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(��ȫ����) | 9.7 | 7.8 | 3.2 | 10.4 |
�ش���������:
��1��FeS2��SԪ�صĻ��ϼ�Ϊ_____�ۡ�
��2������ʱ�����̿��е���Ҫ�ɷ�MnO2��FeS2����������ԭ��Ӧ,д���÷�Ӧ�Ļ�ѧ����ʽ:___
��3�������Һ�д��������Ŀ����__________(�����ӷ���ʽ��ʾ)��
��4������pH����ѷ�Χ��_______,�����ijɷ���______(�ѧʽ)��
��5��(CH3)2CNS2H����(CH3)2NH��CS2ͨ���ӳɷ�Ӧ�õ�,1mol(CH3)2NH��,���ۼ�����ĿΪ__NA��
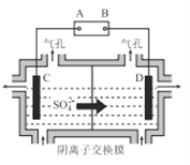
��6����ҵ�ϲ�����ͼ��ʾ�ķ�����ý���Mn��B��Ϊ____������û�������ӽ���Ĥ,Mn2+����D��������Ӧ����MnO2,��缫��ӦʽΪ____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com