
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 在氨水中水分子和氨分子之间也存在着氢键 | |
| D. | 分子间作用力较弱,破坏它所需能量较少 |
分析 A.根据氢键对冰的结构、密度的影响判断;
B.稳定性与化学键有关,与氢键无关;
C.NH3与水分子及氨分子之间存在氢键;
D.分子间作用力比化学键弱得多,破坏分子间作用力需要的能力较少.
解答 解:A.氢键具有方向性,氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大.当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的间隙减小,密度反而增大,故A正确;
B.物质的稳定性属于化学性质,与化学键有关,氢键不是化学键,故与氢键无关,故B错误;
C.NH3与水分子之间存在氢键,氨根子间也存在氢键,故C正确;
D.分子间作用力比化学键弱得多,破坏分子间作用力需要的能力较少,故D正确.
故选B.
点评 本题考查了氢键、分子间作用力,题目难度不大,注意把握氢键对物质性质的影响.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:X<Y<Z | |
| B. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| C. | 原子半径:按X、Y、Z变小 | |
| D. | 气态氢化物稳定性:按X、Y、Z顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
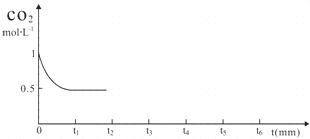
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
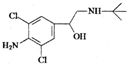
| A. | 该物质的分子式为C12H18ON2Cl2 | |
| B. | 该物质易溶于盐酸 | |
| C. | 该物质的1H核磁共振谱图中有8个吸收峰 | |
| D. | 该物质能发生的类型有:加成反应、酯化反应、消去反应、氧化反应等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y | |
| B. | 非金属性:X>Y | |
| C. | 最高价氧化物对应的水化物酸性:X>Y | |
| D. | 原子半径:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
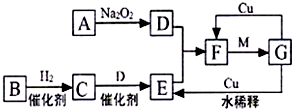 下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体.
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图(某些反应的条件和生成物已略去),其中A、B、D在常温下均为无色无刺激性气味的气体,M是最常见的无色液体. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com