
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
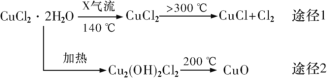
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法错误的是
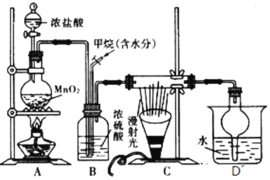
A.实验时先点燃A处酒精灯再通甲烷
B.从D中分离出盐酸的方法为过滤
C.装置C经过一段时间的光照射后,生成的有机物有4种
D.装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室用二氧化锰和浓盐酸共热制备并收集纯净、干燥的氯气,并进行氯气性质的探究。
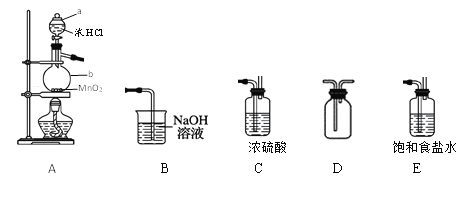
(1)仪器a、b的名称是____。
(2)以上装置A、B、C、D、E从左到右的连接顺序为____________。
(3)如何检查装置A的气密性?____。
(4)装置A中发生反应的离子方程式为____。
(5)装置B的作用是___,有同学觉得此装置不够完善,请你提出改进意见_____。
(6)该小组同学设计如图所示装置探究氯气的氧化性。通入氯气时硬质玻璃管中的现象是__,原因是__(用化学方程式解释)。
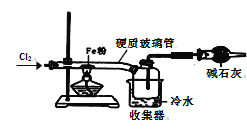
(7)二氯化硫(S2Cl2)在工业上用于橡胶的硫化。为了在实验室合成S2Cl2,该小组用下图装置将干燥的氯气在110~140℃与硫反应,即可得S2Cl2粗品。写出发生反应的化学方程式为______。
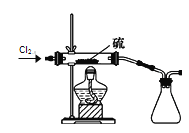
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间在相应条件下转化均能一步实现的是( )
A.SiO2![]() H2SiO3
H2SiO3![]() Na2SiO3(aq)
Na2SiO3(aq)
B.Ca(OH)2![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
C.MgCl26H2O![]() MgCl2
MgCl2![]() Mg
Mg
D.N2![]() NO2
NO2 ![]() HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铜和 Fe2O3 的混合物中加入 200mL1.5 mol·L-1的稀硫酸,完全反应后固体无剩余,得到的溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法正确的是( )
A.原混合物中 Cu 和 Fe2O3 的质量之比为 1∶2
B.反应后的溶液中 CuSO4 的物质的量的浓度为 1mol/L
C.若用 CO 还原等质量的原混合物,充分反应后,质量将减少 4.8 克
D.该反应过程均发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:废液中含+6 价铬的化合物毒性较大污染性强,常用 NaHSO3 将废液中的Cr2O72-还原成 Cr3+。请配平该反应的离子方程式:_____ Cr2O72-+_____HSO3-+____H+ = ____Cr3++_____SO42-+_____H2O
并用双线桥标出电子转移的方向和数目____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质 A、B 和气体甲、乙、丙以及物质 C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
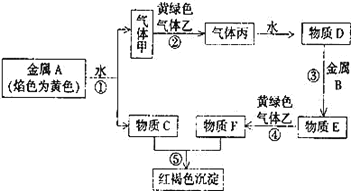
请回答下列问题:
(1) A 的化学式为_____,F 的化学式为_____;
(2) 写出 C 溶液与 Al 反应的离子方程式_____。
(3) 写出 C 溶液与黄绿色气体乙反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。

(1)c的名称是________________
(2)检查装置气密性:在b和f中加水,水浸没导管a和e末端,______________(填操作步骤),微热c,容量瓶f有气泡冒出,导管a内形成一段水柱;停止加热,_________________________,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。
①向c中通水蒸气的目的是________________________________;
②c中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将__________(填“偏高”“偏低”或”不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因_______________________________。
(4)向馏出液中加入V1ml c1 mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________(写出表达式即可,不需化简)。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
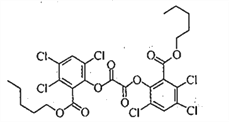
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com