金属钠、钙等在氧气中燃烧可生成过氧化物.从组成上分析,过氧化物为金属氧化物,可能会与水、二氧化碳、二氧化硫反应生成盐.
(1)取一支小试管,向其中加入过氧化纳固体,然后加入少量蒸馏水,将带余烬的小木条插入试管中,观察到的现象是
有气体放出,小木条复燃
有气体放出,小木条复燃
,反应后,向其中滴入酚酞溶液,观察到的现象是
溶液变红
溶液变红
.该反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.
(2)有两个实验小组的同学用如图所示的装置进行实验,来探究过氧化钠与二氧化硫的反应
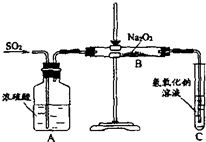
请回答下列问题:
①装置C中氢氧化钠溶液的作用是
吸收二氧化硫气体
吸收二氧化硫气体
②甲组同学认为Na
2O
2与SO
2反应生成了Na
2SO
3和O
2,该反应的化学方程式是:
2Na2O2+2SO2=4Na2SO3+O2↑
2Na2O2+2SO2=4Na2SO3+O2↑
请设计一种实验方案证明Na
2O
2与SO
2反应生成的白色固体中含有Na
2SO
3.
取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体
取白色固体,加入稀硫酸,产生能使品红溶液褪色的气体
③乙组同学认为Na
2O
2与SO
2反应除了生成Na
2SO
3和O
2外,还有Na
2SO
4生成.为检验是否有Na
2SO
4生成,他们设计了如下方案:
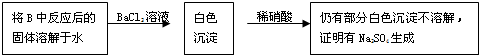
上述方案是否合理?
不合理
不合理
.请简要说明两点理由:①
稀硝酸能使亚硫酸钡转化为硫酸钡
稀硝酸能使亚硫酸钡转化为硫酸钡
;②
若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-
若反应后残留过氧化钠,它溶于水后能将SO32-转化为SO42-
.
(3)为了解决养金鱼的吸氧问题,可在水中加入过氧化钙.某过氧化钠样品2.0g,加入到足量的水中,在标准状况下生成了224mL氧气.试计算该样品中含过氧化钙的质量分数.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案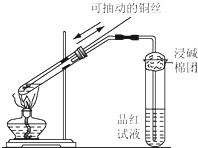 某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.

 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: 用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则:
用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则: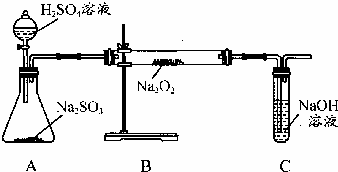 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题