
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式___,如图的曲线中__(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。

(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1L的容器中加入1molN2、3molH2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=___。
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为___。

【答案】N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92kJ·mol-1 b BD
2NH3(g);ΔH=-92kJ·mol-1 b BD ![]() N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
【解析】
(1)根据图1计算出反应热,写出热化学方程式.注意物质状态,反应热符号等;催化剂能降低反应的活化能;
(2)根据平衡状态的判断依据判断;只要满足正反应速率等于逆反应速率,即可判断;
(3)根据“三行式”来进行计算得出结论;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,酸性条件下生成氨气。
(1)由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,所以合成氨的热化学反应方程式为N2(g)+3H2(g)![]() 2NH3(g) △H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低,故答案为b;
2NH3(g) △H═-92kJ/mol,催化剂能降低反应的活化能,b活化能较低,故答案为b;
(2)A.3υ(H2)正=2υ(NH3)逆说明:v(NH3)逆:v(H2)正═3:2不等于对应化学计量数之比,即正反应速率不等于逆反应速率,故A错误;
B.单位时间内生成nmolN2的同时生成2n molNH3说明正反应速率等于逆反应速率,故B正确;
C.体积不变,气体的质量不变,密度也会不变,用密度不变无法区分非平衡状态和平衡状态,故C错误;
D.反应N2(g)+3H2(g)![]() 2NH3(g)是反应前后气体的总物质的量不相等的反应,当体积固定时,根据阿伏伽德罗定律可知,温度、体积相同时,气体的物质的量之比等于压强之比,容器内气压不随时间变化,说明气体的总物质的量不再发生变化,即说明可逆反应达到了化学平衡状态,故D正确;
2NH3(g)是反应前后气体的总物质的量不相等的反应,当体积固定时,根据阿伏伽德罗定律可知,温度、体积相同时,气体的物质的量之比等于压强之比,容器内气压不随时间变化,说明气体的总物质的量不再发生变化,即说明可逆反应达到了化学平衡状态,故D正确;
故答案为BD;
(3)根据题意:N2(g)+3H2(g)2NH3(g)
初始物质的量浓度:1 3 0
变化物质的量浓度:a 3a 2a
平衡物质的量浓度:1-a 3-3a 2a
则平衡常数为K= =
= =
=![]() ;
;
(4)电解池的阴极发生得电子的还原反应,在合成氨中,氮气得电子,所以阴极反应为:N2+6H++6e-=2NH3。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
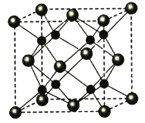
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如图1:

已知:①Cr(OH)3(两性氢氧化物)呈绿色且难溶于水
②Pb(NO3)2、Pb(CH3COO)2均易溶于水,PbCrO4的Ksp为2.8×10﹣13,Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
③六价铬在溶液中物种分布分数与pH关系如图2所示。

④PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
(1)实验时需要配置100mL3molL﹣1CrCl3溶液,现有量筒、玻璃棒、烧杯,还需要玻璃仪器是___。
(2)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是_____。
(3)“氧化”时H2O2滴加速度不宜过快,其原因是_____;“氧化”时发生反应的离子方程式为___。
(4)“煮沸”的目的是_____。
(5)请设计用“冷却液”制备PbCrO4的实验操作:_____[实验中须使用的试剂有:6molL﹣1的醋酸,0.5molL﹣1Pb(NO3)2溶液,pH 试纸]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A. 29∶8∶13 B. 22∶1∶14 C. 13∶8∶29 D. 44∶2∶28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )

A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
B. NaCl![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
C. SiO2![]() Si
Si![]() SiCl4
SiCl4
D. AgNO3![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) ![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、CO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol SiO2中含有Si-O键为4NA
B.1 mol氢氧化铁胶粒所含氢氧化铁的分子数为NA
C.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D.足量的Fe和1mol Cl2完全反应,转移的电子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com