
| A. | C2H6、C2H4O | B. | C2H4O、C2H4O2 | C. | C2H6O、C3H6O3 | D. | C3H8O3、C2H4O2 |
分析 根据题意可知,有机物无论以何种物质的量的比例混合,只要总物质的量一定,完全燃烧消耗氧气的量为一恒定值,可假设有机物的物质的量都为1mol,混合物中的两种有机物物质的量相同时,完全燃烧消耗的氧气的物质的量相等,无论以何种物质的量的比例混合,完全燃烧消耗氧气的量为一恒定值,根据消耗氧气的量为x+$\frac{y}{4}$(x为C原子数,y为H原子数)计算,如有机物中含有O原子,利用分子式拆写的方法计算.
解答 解:A.1molC2H6完全燃烧消耗3.5mol氧气,1molC2H4O完全燃烧消耗2.5mol氧气,二者不相等,故A错误;
B.1molC2H4O完全燃烧消耗2.5mol氧气,1molC2H4O2完全燃烧消耗2mol氧气,二者不相等,故B错误;
C.1molC2H6O完全燃烧消耗3mol氧气,1molC3H6O3完全燃烧消耗3mol氧气,二者相等,故C正确;
D.1molC3H8O3完全燃烧消耗3.5mol氧气,1molC2H4O2完全燃烧消耗2mol氧气,二者不相等,故D错误;
故选C.
点评 本题考查混合物计算,题目难度不大,正确分析题干选项得出各组分耗氧量相等为解答关键,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
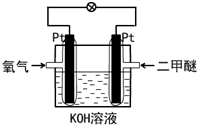
| A. | 电流流向:右边Pt电极→导线→左边Pt电极 | |
| B. | 通入氧气这边的Pt电极为负极 | |
| C. | 溶液中OH-向右边Pt电极移动 | |
| D. | 通入二甲醚的电极反应式:12OH-+CH3OCH3-12e-=2CO2+9H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.60 | 19.65 | 19.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是极性(填“极性”或“非极性”)键形成的非极性分子.
,它是极性(填“极性”或“非极性”)键形成的非极性分子.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol铜片与含2molH2SO4的浓硫酸共热 | |
| B. | 1molMnO2粉末与含2molH2O2的溶液共热 | |
| C. | 常温下1mol铝片投入足量的浓硫酸中 | |
| D. | 常温下1mol铜片投入含4molHNO3的浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com