
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电引力形成的化学键,叫共价键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 含有离子键的化合物不一定是离子化合物 |
分析 A.共价化合物中一定不含有离子键;
B.相邻原子间强烈的相互作用是化学键,离子键是由阴阳离子通过静电作用形成的;
C.含有共价键的化合物中也可能含有离子键;
D.含有离子键的化合物一定是离子化合物.
解答 解:A.因含离子键的化合物一定为离子化合物,则共价化合物中一定不含有离子键,故A正确;
B.离子键是由离子形成的,即阴阳离子之间通过静电作用(既有吸引也有排斥)形成离子键,相邻原子间强烈的相互作用是化学键,故B错误;
C.含有共价键的化合物中也可能含有离子键,如NaOH,故C错误;
D.含有离子键的化合物一定是离子化合物,故D错误;
故选A.
点评 本题考查化学键、离子化合物、共价化合物,明确概念及概念的关系是解答本题的关键,并学会利用实例来说明问题,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
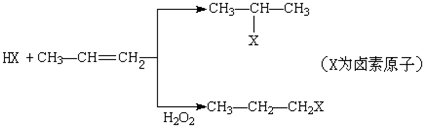
 的物质,该物质是一种香料.
的物质,该物质是一种香料.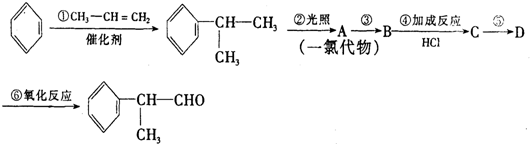
 ,
,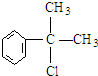 .
.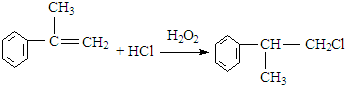 .反应⑤的化学方程式为(有机物写结构简式,并注明反应条件):
.反应⑤的化学方程式为(有机物写结构简式,并注明反应条件): +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$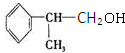 +NaCl.
+NaCl.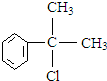 的水解产物
的水解产物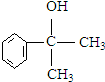 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. ,
, ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
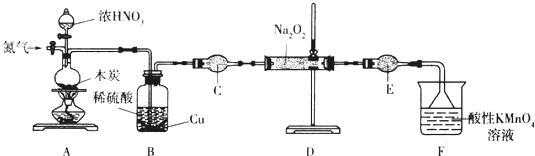
| 滴定次数 | 1 | 2 | 3 | 4 |
| KmnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向NaHCO3溶液中加入过量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com