
| ѡ�� | ʵ��Ŀ�� | ʵ�鷽�� |
| A | ��֤��������Ư���� | ��������ͨ����ˮ�У�����Һ��ɫ�Ƿ���ɫ |
| B | �����Ȼ�����Һ���Ƿ�FeCl2 | ���Ȼ�����Һ�еμ�����������Һ |
| C | ����ʳ�����Ƿ�����KIO3 | ȡʳ������������KI��Һ�����������Һ���۲���Һ�Ƿ���� |
| D | ��֤Ksp��AgI����Ksp��AgCl�� | �����ʵ���NaCl��KI�Ļ��Һ�еμ�AgNO3��Һ���۲������ɫ |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A�����������ܱ�ǿ���������������ֻ�ԭ�ԣ�
B���������Ӻ����������ӷ�Ӧ���ɰ�ɫ����������������������ת��Ϊ����ɫ������ת��Ϊ���ɫ��
C���������ⵥ�ʱ������������������£�I-���ܻ�ԭIO3-��
D���ܶȻ��������������ת��Ϊ�ܶȻ�����С�����ʣ�
��� �⣺A�����������ܱ�ǿ���������������ֻ�ԭ�ԣ������ǿ�����ԣ�����������巢��������ԭ��Ӧ��ʹ��ˮ��ɫ�����ֶ�������ԭ�Զ�����Ư���ԣ���A����
B���������Ӻ����������ӷ�Ӧ���ɰ�ɫ����������������������ת��Ϊ����ɫ������ת��Ϊ���ɫ���������Ӻ��������������ɵ�����������ɫ����������������ɫ�����������飬��B����
C��ֻ�����������£�I-���ܻ�ԭIO3-������5I-+IO3-+6H+=3I2+3H2O�����ɵĵ��ʵ������۱��������ʵ��û���ṩ����������������ɣ���C����
D���Ȳ�����ɫ������֤��Ksp��AgI����Ksp��AgCl�����ܴﵽʵ��Ŀ�ģ���D��ȷ��
��ѡD��
���� ���⿼�黯ѧʵ�鷽�����ۣ�Ϊ��Ƶ���㣬�漰�����������ʡ����Ӽ��顢������ԭ��Ӧ��������ת����֪ʶ�㣬�������ʵ����ʡ���Ӧԭ��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�ѶȲ���


 ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
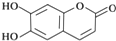
| A�� | M�ķ���ʽ��C9H6O4 | |
| B�� | 1molM�������2molBr2������Ӧ | |
| C�� | M��������NaOH��Һ������Ӧʱ�������л�����Ļ�ѧʽΪC9H4O5Na4 | |
| D�� | 1molM������NaHCO3��Ӧ������2molCO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaHSO4��Һ�м������Ba��OH��2��Һ��H++SO42-+Ba2++OH-�TBaSO4��+H2O | |
| B�� | ���������Һ�м����������ƣ�SO32-+Ca2+�TCaSO3�� | |
| C�� | NH4HCO3��Һ�м�����NaOH��Һ���ȣ�HCO3-+NH4++2OH-$\frac{\underline{\;\;��\;\;}}{\;}$CO32-+NH3��+2H2O | |
| D�� | ����������Һ�м����������ữ��˫��ˮ��2Fe2++2H++H2O2�T2Fe3++2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
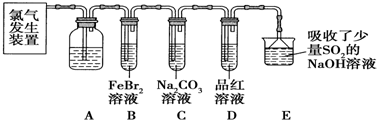
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
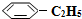 �����������ϵ��屽��ϩ��
�����������ϵ��屽��ϩ��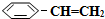 ������ԭ����Ӧ�ǣ�
������ԭ����Ӧ�ǣ�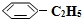 ��g��?
��g��?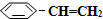 ��g��+H2��g����H=+125kJ•mol-1��
��g��+H2��g����H=+125kJ•mol-1��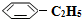 ��g������2L����ܱ������з�����Ӧ���ⶨ�������ڵ����ʣ��õ��������±���
��g������2L����ܱ������з�����Ӧ���ⶨ�������ڵ����ʣ��õ��������±���| ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n��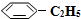 ��/mol ��/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n��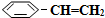 ��/mol ��/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
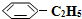 ��g����ƽ��ת������ˮ��������������ϵ��ѹǿ�Ĺ�ϵ��ͼ1��ʾ����������������ʱ��ˮ����������Խ��ƽ��ת���ʽ�Խ���Խ����ԽС�����䡱����ԭ������ϵ��ѹǿһ��ʱ��ˮ�����ķ�ѹԽ��ƽ����ϵ�ķ�ѹԽС��ƽ���������������ķ����ƶ�
��g����ƽ��ת������ˮ��������������ϵ��ѹǿ�Ĺ�ϵ��ͼ1��ʾ����������������ʱ��ˮ����������Խ��ƽ��ת���ʽ�Խ���Խ����ԽС�����䡱����ԭ������ϵ��ѹǿһ��ʱ��ˮ�����ķ�ѹԽ��ƽ����ϵ�ķ�ѹԽС��ƽ���������������ķ����ƶ�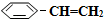 ��g����H2��g����������40minʱ�ﵽ����ͬ����ƽ��״̬������ͼ2�л�����������������
��g����H2��g����������40minʱ�ﵽ����ͬ����ƽ��״̬������ͼ2�л�����������������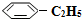 ��g����
��g����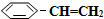 ��g����Ũ��c��ʱ��t�仯�����ߣ�
��g����Ũ��c��ʱ��t�仯�����ߣ�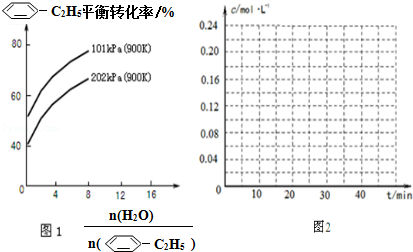
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ᣨH3BO3�������ᣨH3AlO3���ṹ���ƣ���д��B��OH��3��
���ᣨH3BO3�������ᣨH3AlO3���ṹ���ƣ���д��B��OH��3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com