

分析 浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速,干燥的空气进入装置b中和样品高温反应,元素化合价降低的为铜元素化合价从+2价变化为0价,氧元素化合价从0价变化为-2价,元素化合价降低做氧化剂被还原,反应为8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,通过装置c中铜网除去过量的氧气,
(1)依据化学方程式中元素化合价变化分析,元素化合价降低的被还原,根据称取研细的黄铜矿样品0.230g,选择精确度较高的仪器;
(2)利用铜网除去未反应的氧气,避免影响后续试验验证;
(3)反应产生的二氧化硫应该尽可能的被d装置吸收;
(4)根据滴定管的读数方法读出消耗碘溶液的体积,反应原理是碘单质氧化二氧化硫生成硫酸和碘化氢;
(5)先找出黄铜矿和二氧化硫及碘单质的关系式CuFeS2~2SO2~2I2,再根据题中数据进行计算;
(6)若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可利用KMnO4溶液褪色来证明.
解答 解:(1)由于称量黄铜矿样品1.150g,精确度达到了千分之一,应该选用电子天平进行称量,把黄铜矿样品研细,可以增大接触面积,从而提高反应速率,并且使黄铜矿充分反应,
故答案是:电子天平;
(2)气体通过装置c中铜网,加热条件下和气体中剩余氧气反应,
故答案为:除去混合气体中未反应的氧气;
(3)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然需要通入一段时间的空气,可以将b、d装置中的二氧化硫全部排出去,使结果更加精确,
故答案为:将系统装置中SO2全部排入d中充分吸收;
(4)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,滴定的原理反应的化学方程式为:I2+SO2+2H2O=H2SO4+2HI,
故答案为:20.00;I2+SO2+2H2O=H2SO4+2HI;
(5)根据硫原子守恒和电子守恒找出关系式:CuFeS2~2SO2~2I2,消耗掉0.01mo1/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.01mol/L×0.0200L=0.000200mol,所以黄铜矿的质量是:$\frac{1}{2}$×0.000200mol×184g/mol×10=0.184g,所以其纯度是:$\frac{0.184}{1.15}$×100%=16%,
故答案为:16%;
(6)若Fe2O3中含有FeO,利用稀酸(非氧化性)溶解后生成的亚铁离子,则具有还原性,而给出的试剂中KMnO4溶液具有强氧化性,可使KMnO4溶液褪色,
则选择试剂为稀硫酸、KMnO4溶液,操作为取少量固体溶于稀硫酸,然后滴加KMnO4溶液,观察到溶液使KMnO4溶液褪色,则证明含有FeO,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
点评 本题考查了探究黄铜矿的纯度,涉及了仪器选择、纯度计算等知识,充分考查了学生分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 14g分子式为CnH2n的烃中含有的C-H键的数目一定为2NA | |
| B. | 1mol Fe与水蒸气反应生成的氢气为22.4L | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| D. | 0.1mol H2S分子中含氢离子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,ZX与水反应放出的气体的化学式为H2.
,ZX与水反应放出的气体的化学式为H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.| 金属离子 | Al3+ | Zn2+ | Mg2+ |
| 与EDTA反应的pH | 4 | 5~6 | 9.5~10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应. .
.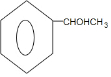 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. (填结构简式)
(填结构简式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com