
| A. | 79、81 | B. | 45、46 | C. | 44、45 | D. | 44、46 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
| 编号 | A的分子式 | B的分子式 | VA:VB |
| ① | C4H10 | C3H6 | 3:2 |
| ② | C4H10 | C2H4 | 4:1 |
| ③ | C4H10 | C2H2 | 4:1 |
| ④ | C4H10 | C3H4 | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水溶液能导电 | B. | 易溶于水 | C. | 熔化时能导电 | D. | 有较高的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
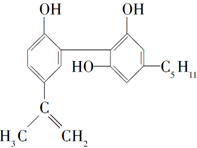 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如下.关于它的说法正确的是( )| A. | 它的化学式为C19H26O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | C | |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
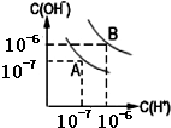 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
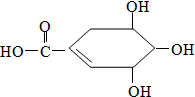 防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )| A. | 莽草酸的分子之间不能发生酯化反应 | |
| B. | 莽草酸的分子式为C7H10O5 | |
| C. | 莽草酸中含有苯环 | |
| D. | 莽草酸不能使溴水褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com