
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 在研究原子结构的过程中建立起的各种模型属于思维模型 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
分析 化学研究的基本方法有:观察、实验、分类、比较等方法,除此之外,建立假说和化学模型在研究物质的结构和性质时也起着重要的作用;研究物质性质的基本程序为:观察物质的外观性质、预测物质的性质、实验和观察、解释和结论,由此分析解答.
解答 解:A.是在已有事实材料和科学理论基础上,对某些事物的存在或事物的因果性、规律性作出的假定性解释,经过反复验证和修正,才发展成为科学的理论,故A正确;
B.观察、实验、分类、比较等是研究物质性质的基本方法,故B正确;
C.模型一般可分为物体模型和思维模型,而在研究原子结构的过程中建立起的各种模型属于思维模型,故C正确;
D.分散系的划分是以分散质颗粒大小来区分的,胶体粒子直径介于1nm~100nm之间,溶液溶质粒子直径小于1nm,浊液粒子直径大于100nm,溶液和浊液都不具有丁达尔效应,故D错误;
故选D.
点评 本题考查了研究物质性质的基本方法和基本程序,侧重对课本基础知识的考查,题目难度不大,加强对课本基础知识的记忆和理解是解题的关键.


科目:高中化学 来源: 题型:解答题
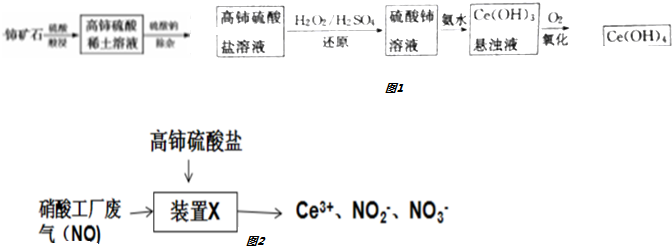
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | 标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2 NA | |
| D. | 将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH溶液做导电实验,灯泡很暗,证明CH3COOH是弱电解质 | |
| B. | pH相同的醋酸和盐酸,取等体积的两种酸溶液分别稀释至原溶液体积的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n | |
| C. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小且c(NH4+)/c(NH3•H2O)的值增大 | |
| D. | 常温下,CH3COOH的Ka=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O的溶液中的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,在等体积、等浓度的硝酸中加入氨水,溶液的导电性增强 | |
| C. | 25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积PH=1的盐酸和水混合,混合后溶液的PH=1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )
如图是病人输液用的葡萄糖(分子式为C6H12O6)注射液的标签上的部分内容.据标签所提供的信息,以下说法错误的是( )| A. | 该注射液中葡萄糖的质量分数是5% | |
| B. | 葡萄糖的摩尔质量为180g•mol-1 | |
| C. | 该注射液的密度约为1g•mL-1 | |
| D. | 该注射液中葡萄糖的物质的量浓度约为0.014 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol•L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| D. | O2的摩尔体积约为22.4 L•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com