
| A、3mol?L-1氨水的浓度不够大,溶液的碱性不够强 |
| B、NaF溶液碱性较强,Al3+完全反应生成AlO2-,而AlO2-不能与氨水反应生成Al(OH)3 |
| C、氨水为弱碱溶液,Al3+不与弱碱反应 |
| D、Al3+与F-结合生成新物质,溶液中几乎没有Al3+ |


科目:高中化学 来源: 题型:
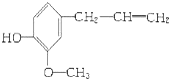 该物质不应有的化学性质是( )
该物质不应有的化学性质是( )| A、①③ | B、③⑥ | C、④⑥ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应进行的前3min内,用X表示的反应速率v(X)=0.3mol?L-1?min-1 |
| B、容器中发生的反应可表示为:3X(g)+Y(g)═2Z(g) |
| C、保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | ||
| B、根据滴定曲线,可得Ka(HY)≈10-5 | ||
| C、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | ||
D、HY与HZ混合,达到平衡时:c(H+)═
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、漂白粉溶液中通入过量CO2气体:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| D、向NH4Al(SO4)2溶液中不断滴加Ba(OH)2至溶液中SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
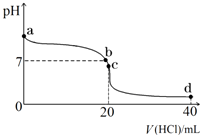 室温下,若将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol?L-1盐酸滴入20mL 0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com